- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
CDX 、 PDX 、同源小鼠模型
人源化重建小鼠模型
肿瘤耐药模型
原位和转移活体成像相关模型
炎症自免疾病研究平台
关节炎相关炎症和自免疾病模型
呼吸疾病相关炎症和自免疾病模型
系统性自免性疾病相关模型
神经系统疾病研究平台
衰老等精神类疾病模型
代谢及心脑血管疾病研究平台
心脑血管疾病模型
肝病、糖尿病、肾病、肥胖等疾病模型
皮肤类疾病研究平台
皮肤类疾病模型
毛发类疾病相关模型
眼病相关疾病研究平台
视网膜病变
晶状体变性/眼底微循环病变
视神经退行性病变
特殊疾病研究平台
放射性疾病相关药效模型
感染类疾病相关药效模型
GVHD模型
医疗器械评价研究平台
生物相容性评估
敷料类医疗器械有效性,安全性评估
医美产品医疗器械有效性,安全性评估
药代动力学
体内DMPK研究
体外ADME研究
安评
急毒,长毒,一般毒理
安全毒理
免疫原性评价
免疫毒性评价
非GLP毒理
- 加入我们
- 联系我们
news

糖尿病
糖尿病疾病介绍
糖尿病是一组以血浆葡萄糖(简称血糖)水平升高为特征的代谢性疾病群。引起血糖升高的病理生理机制是胰岛素分泌缺陷或胰岛素作用缺陷。血糖明显升高时可出现多尿、多饮、体重减轻,即“三多一少”症状,糖尿病(血糖)一旦控制不好易引发并发症,导致肾、眼、足等部位的病变。糖尿病分为I型糖尿病(Type1 diabetes,T1D)、Ⅱ型糖尿病(Type2 diabetes,T2D)和其它特异性糖尿病。目前临床上主要见到的就是前两种,因此下面介绍的动物模型主要围绕这两种类型而展开。
I型糖尿病(Type1 diabetes,T1D),也叫胰岛素依赖型糖尿病(Insulin dependent diabetesmellitus,IDDM)或青少年糖尿病,是一种自身免疫性疾病,多发生在儿童和青少年,也可发生于各种年龄。其根本机制是负责产生胰岛素的胰脏β细胞被自体免疫系统错误地破坏,导致内源性胰岛素缺乏并引起高血糖症。典型的I型糖尿病症状包括:尿频、口渴、口干、皮肤发痒或干燥、食欲增加、体重减轻等。
Ⅱ型糖尿病是由于胰岛素抵抗及胰岛素分泌不足所致,以往称为非胰岛素依赖型糖尿病(Non-Insulin dependent diabetesmellitus,NIDDM)、成年发病型糖尿病,常伴有明显的遗传因素,但遗传机制尚未阐明。其它特异性糖尿病包括:β细胞功能的基因缺陷、胰岛素作用的基因缺陷、胰腺外分泌疾病、内分泌疾病、药物或化学制剂所致的糖尿病、感染、非常见型免疫介导性糖尿病以及有并发糖尿病的其它遗传综合症
糖尿病疾病动物模型
目前研究I型糖尿病最常见的几类大小鼠模型有:自发性自身免疫模型;化学药物诱导模型;遗传诱导模型。动物呈现自发性胰岛炎和进展性β-细胞破坏。
I型糖尿病大小鼠模型
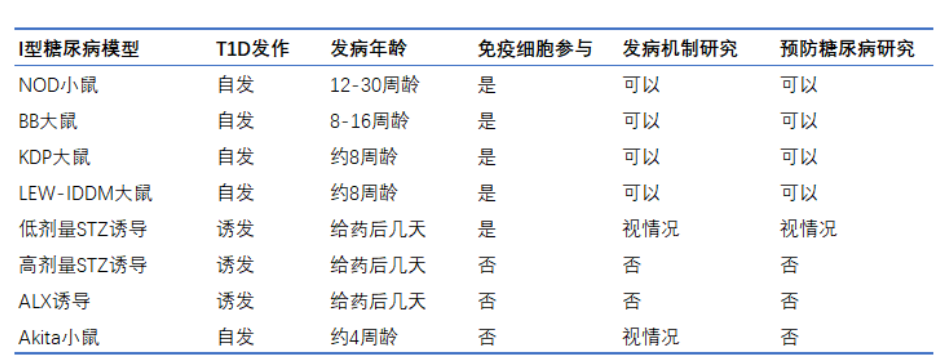
NOD小鼠
NOD(non-obese diabetic,非肥胖糖尿病)小鼠一直是研究自身免疫性糖尿病的主要动物模型。典型的临床症状如尿频、多饮、高血糖、尿糖和高胆固醇血症。与人类1型糖尿病相似,NOD小鼠因自身免疫疾病发展为1型糖尿病。NOD小鼠3-5周龄时开始出现胰岛T细胞浸润,到12周龄时整个胰腺中均存在胰岛炎。小鼠中大约90%的雌鼠和60%的雄鼠在12个月龄时出现高血糖并发展为糖尿病。与其他模型相比,此模型在模拟临床女性糖尿病上或有更多优势。
BB大鼠
BB(Bio-breeding,生物育种)大鼠来自远交系Wistar大鼠,诞生了两个亚系,近交系 BBDP/Wor和远交系 BBdp。BB大鼠作为T细胞依赖性自身免疫性糖尿病模型,其特征包括胰岛自身抗体和谷氨酸脱羧酶抗体,是研究胰岛移植耐受性诱导的首选模型。
BB大鼠在青春期开始出现体重减轻、多尿、高血糖和胰岛素减少症,而且淋巴细胞明显减少。与NOD小鼠不同,BB大鼠酮症酸中毒非常严重,像在人类中一样,必须使用胰岛素治疗。BB大鼠在8-16周龄发生高血糖症,其中3月龄前90%会发展成为糖尿病,且性别间无差异。在糖尿病建立之前的2-3周内发生胰岛炎。
化学药物诱导模型
化学药物诱导动物模型诱发糖尿病常规使用的两种化合物分别是链脲佐菌素(Streptozotocin, STZ)和四氧嘧啶(Alloxan, ALX),其中又以STZ诱导最常用。
链脲佐菌素诱导模型
通过腹腔注射(ip)或静脉注射(iv)给药后,通过GLUT2进入胰腺β细胞,导致DNA的烷基化。随后激活PARP导致NAD+消耗增加,细胞ATP减少,最终使胰岛素产生受到抑制。STZ诱导模型非常类似于人类I型糖尿病,伴有慢性胰岛炎、胰岛炎和胰岛素缺乏症。可在各种不同的大小鼠品系中可预测地快速诱导糖尿病,从而进行同基因、同种异体或异种移植。
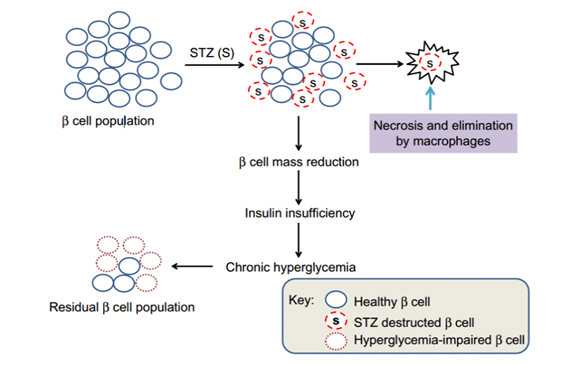
不过STZ具有一定的致癌性,在慢性实验中可能会导致肾脏和肝脏肿瘤的发生。
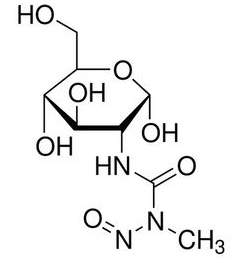
链脲佐菌素分子
四氧嘧啶诱导模型
ALX诱导糖尿病模型的机制主要是胰岛β细胞的快速摄取四氧嘧啶抑制葡糖激酶,以及自由基的过量形成,导致β细胞DNA断裂,最终使β细胞凋亡。ALX在2分钟内就开始发挥作用,根据给药剂量和动物品系的不同可在啮齿动物中诱导慢性高血糖症。不过ALX的致糖尿病剂量窗口很窄,甚至较少的剂量给药就可引起很大的毒性,特别是肾脏毒性。
遗传诱导模型
遗传因素被认为是糖尿病发生与发展的重要因素之一。某些基因的改变会直接诱导糖尿病的发生。
Akita小鼠
Akita杂合子小鼠患有严重的胰岛素依赖型糖尿病(从3-4周龄开始),以高血糖、低胰岛素血症、多尿和多饮症为特征。Akita小鼠是I型糖尿病的重要模型,不出现肥胖。雄性小鼠出现严重的高血糖症,而雌性小鼠血糖升高则不如雄性小鼠那么明显,这可能是由于雌激素的保护作用。Akita纯合子小鼠若不予胰岛素治疗,很少存活超过12周。
Akita杂合子小鼠不需要外源诱导即可快速发生糖尿病,是化学药物诱导模型的理想替代小鼠,也非常适合应用到同种异体或异种胰岛移植相关研究中。Akita小鼠也是II型糖尿病的模型之一,特别是用于研究β细胞内质网应激在糖尿病发病机制中的作用。
Ⅱ型糖尿病大小鼠模型
目前研究II型糖尿病最常见的几类大小鼠模型有:自发性糖尿病动物模型:KK小鼠、ob/ob小鼠、db/db小鼠、和NSY小鼠;转基因糖尿病模型:GK/IRS-1 双基因剔除小鼠、IR+/-/IRS-1+/-双基因剔除杂合体小鼠;妊娠糖尿病模型。
KK小鼠
日本学者培育的一种轻度肥胖型II型糖尿病动物。后与C57BL/6J小鼠杂交,并进行近亲繁殖,得Toronto2(T2kk)小鼠 。将黄色肥胖基因(即Ay)转至KK小鼠,得KK-Ay鼠,与KK小鼠相比,有明显的肥胖和糖尿病症状。从5周龄起,血糖、血循环中的胰岛素水平以及HbA1c水平逐步升高。β细胞有脱颗粒和糖原浸润,随后出现胰岛肥大和中心气泡。肝脂肪化和脂肪组织增多。脂肪组织的胰岛素敏感性降低比KK小鼠明显,且到16周龄时完全丧失。肾脏病变发生早,发展迅速,肾小球基底膜增厚。用KK-Ay鼠可评价抗糖尿病药物的胰腺外作用。
ob/ob小鼠
II型糖尿病动物模型,属常染色体隐性遗传。纯合体动物表现为肥胖,高血糖及高胰岛素血症。症状的轻重取决于遗传背景,ob/ob小鼠(obesemouse)与C57BL/KsJ交配的子代症状严重,而ob/ob与C57BL/6J交配的子代症状则较轻,后者是杂合体。ob/ob小鼠leptin(ob基因产物)缺乏,引起肝脂肪生成和肝糖原异生,高血糖又刺激胰岛素分泌,引起胰岛素抵抗的恶性循环。糖尿病ob/ob小鼠肝PPARγ2 表达水平升高与胰岛素抵抗有关,可能作为一种补偿机制,试图保持胰岛素的敏感性。
db/db小鼠
db/db小鼠(diabetes mouse)由C57BL/KsJ近亲交配株常染色体隐性遗传衍化而来,属II型糖尿病模型。动物在一个月时开始贪食及发胖,继而产生高血糖、高血胰岛素,胰高血糖素也升高。一般在10个月内死亡。糖尿病(C57BL/6Jdb/db)
发生严重的糖尿病症状,类似C57BL/KsJob/ob小鼠,即早发的高胰岛素血症,体重下降和早死。db/db小鼠与ob/ob小鼠不同,可发生明显的肾病。
NSY小鼠
NSY(Nagoya-Shibata-Yasuda)小鼠是一近交系自发性糖尿病模型,是从远交JCL : ICR小鼠中选择糖耐量异常株培育而成的。其糖尿病发生具有年龄依赖性。24周龄时胰岛素分泌功能严重受损,48周的累积发病率雄性为98% ,雌性为31%。此鼠在任何年龄阶段都不表现严重肥胖和显著的高胰岛素血症,胰岛也无肿大或炎性变化。胰岛β细胞分泌胰岛素功能受损和胰岛素抵抗可能是NSY小鼠发生NIDDM的机制,与人的NIDDM发病机理相似。
GK/IRS-1 双基因剔除小鼠
IRS-1- P-小鼠表现为胰岛素抵抗,但由于β细胞代偿性增生,胰岛素分泌增多,糖耐量正常。β细胞特异GK表达降低的小鼠,显示轻度糖耐量异常。两者杂交产生的GKPIRS-1双基因剔除小鼠,表现II型糖尿病症状,既有胰岛素抵抗又有糖耐量异常。
IR+/-/IRS-1+/-双基因杂合体剔除小鼠
IR+/-和IRS-1+/-单个基因剔除的杂合体小鼠无明显的的临床症状。而IR+/-PIRS-1+/- 小鼠肝和肌肉中IR 和IRS-1表达水平下降60% ,由胰岛素介导的IR自动磷酸化,IRS-1 和IRS-2 的酪氨酸磷酸化,PI32激酶的p85 亚基与IRS-1 的结合都减少。4~6月前血糖正常,2月时胰岛素水平升高,4~6 月时,发生明显的胰岛素抵抗(表现为血胰岛素水平显著升高和对外源性胰岛素不敏感),6月时,40%的杂合体双突变鼠表现糖尿病症状。
IRS-2-/-小鼠
IRS-2-/-小鼠表现为胰岛素抵抗和胰岛素分泌不足(不能引起β细胞代偿性增生,无法对抗胰岛素抵抗) ,从而引发II型糖尿病。但IRS-2-/-小鼠单个β细胞胰岛素分泌正常甚至升高。
STZ加高脂饮食诱发Ⅱ型糖尿病模型
STZ加高脂饮食诱发II型糖尿病模型,建模具体方法如下:取40只成年雄性SD大鼠(180-200g),随机分为三组,正常组(10只)、高脂饲料组(10只)、试验组(20只),正常组给予基础饲料喂养,高脂饲料组和试验组均给予高脂饲料(88.8%基础饲料、1%胆固醇、10%猪油和0.2%胆盐)喂养。于喂养的第28天晚禁食过夜,在第29天上午采尾血测定血糖和血脂。取样后给予试验组大鼠一次性腹腔注射STZ 40mg/kg。七天后取尾血测血糖,以血糖 > 16.7mmol/L为糖尿病。
示例
参考文献
[1] 陈昕涛, 王敏君, 严文韬,等. 1型糖尿病动物模型和干细胞治疗的研究进展[J]. 癌变.畸变.突变, 2019, 31(4):4.
[2] 唐艺丹, 王鲜忠, 张姣姣. Ⅱ型糖尿病动物模型构建的研究进展[J]. 中国实验动物学报, 2020, 28(6):7.
[3] Kerner W, Brückel J; German Diabetes Association. Definition, classification and diagnosis of diabetes mellitus. Exp Clin Endocrinol Diabetes. 2014 Jul;122(7):384-6. doi: 10.1055/s-0034-1366278.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501
北京阳光诺和药物研究股份有限公司
办公地址:北京市昌平区双营西路79号院7号楼
总公司网址:http://www.sun-novo.com




