- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

脑立体定位技术|动物模型赋能精神与神经系统疾病的研究
1.前言
脑立体定位技术被广泛运用于对特定核团或脑区的操控(激活或抑制)、给药、病毒标记和信号采集等实验中,成为研究脑的结构和功能必不可少的实验手段。该技术以脑立体定位仪为主要定位仪器,结合动物颅骨外表面固定标志(如小鼠的前囟、后囟等位点)以及标准脑图谱,来确认目标核团或脑区的坐标;再通过手术方式将外界的干预手段施于目标位置,在非直视暴露下对其进行精确定点操控、损毁、给药、病毒标记和信息采集等,成为神经科学各领域不可或缺的研究手段。下面详细介绍确定脑立体定位位点坐标的方法,以及脑立体定位实验过程中的注意事项。

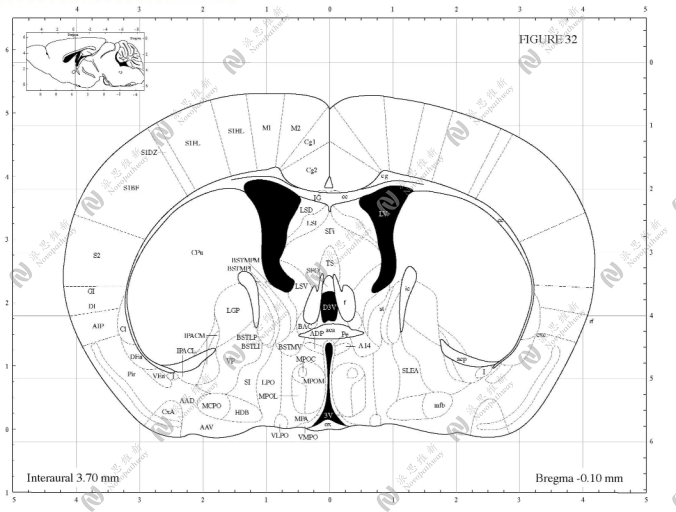
1.1根据实验目的和大小鼠种类的不同,选择相对应的脑立体定位图谱,实验动物的体重应尽量和图谱一致。
1.2查找目标核团所相对应的页码及坐标。
1.3核团所在的页面,多是冠状切面,在各页面上挑选一个横截面最大的,在核团中心点一点,经这个点划水平线和垂直线,水平线和纵坐标的交点就是核团的深度坐标(颅骨下多少mm),垂直线和横坐标的交点就是核团左右坐标(中线旁开多少mm)。例如小鼠侧脑室常用定位:X=1.00 mm, Y= 0.80 mm, Z= 1.5 mm
2、脑立体定位基本操作
2.1 将麻醉的鼠固定到立体定位仪上,先将鼠门齿卡在适配器门齿夹上,轻轻压上门齿夹横杆,调整适配器高度和前后,使耳杆可以方便进入鼠外耳道,且调整定位仪的门齿杆位置达到颅骨水平位。检查是否鼻对正中,头部不动,提尾不掉,目测大脑放置是否水平。
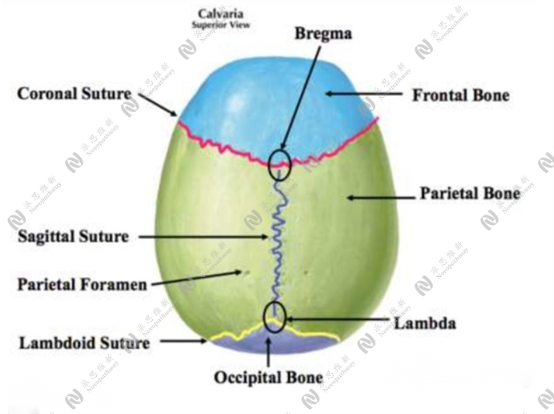
2.2先用手术剪把头颅顶部的毛剪去,经酒精常规消毒后,切开颅顶正中的皮肤,分离皮下组织,用过氧化氢除净颅骨上组织,露出前卤及人字缝。
2.3根据确定脑立体定位坐标,以前前囟点为零点,移动操作臂,用笔标记出核团中心点位置。小心地用颅骨钻在注射位点处轻磨颅骨,将颅骨慢慢打薄,钻孔时一定要小心,避免钻通颅骨后钻入脑组织。
2.4最后根据自己的实验需求进行相对应的试验操作,操作完毕以后清理创口,局部常规消毒,缝合皮肤,术后给予青霉素钠盐4万单位肌肉注射防止感染,每天1次,连续3d。
3、脑立体定位实验相关注意事项
3.1颅骨水平位定位操作:定位时将动物固定成颅骨水平位后,先定位到前囟,以前囟为原点,向前或向后、向左或向右、向下(先在颅骨上打孔)到达核团位置,需要强调的是,坐标是以前囟为原点,而不是以钻孔后的脑表面为原点。
3.2注意动物的状态:由于俯卧体位以及脑立体定位仪的夹持,容易造成动物窒息死亡,因此需要随时确认动物气道通畅。另外,对于手术切开的部位,应适当滴加生理盐水,防止伤口干燥。
3.3正式实验之前需进行预实验,为了确定核团定位是否正确,推荐神经顺行示踪的DiI染料于注射后1周或神经逆行示踪的荧光金染料于注射后2周切片,并对照图谱确认注射的核团位点无误,再进行脑内注射,可有效提高脑内定位注射的成功率。
4、派思维新在脑立体定位技术应用方面的案例分享
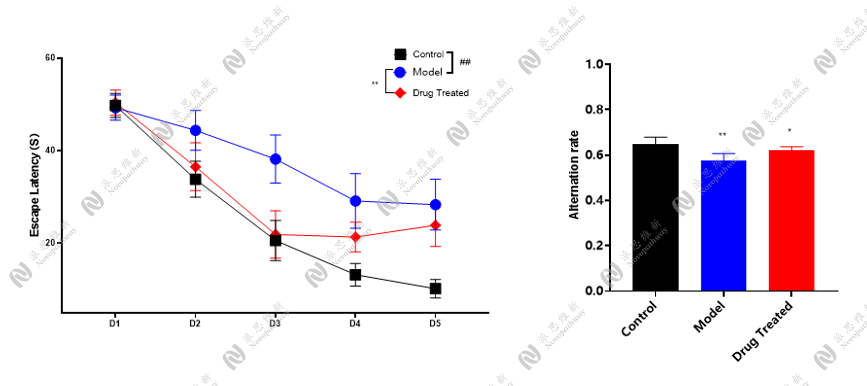
行为学检测:水迷宫、Y迷宫
4.2 脑立体定位技术-药物注射
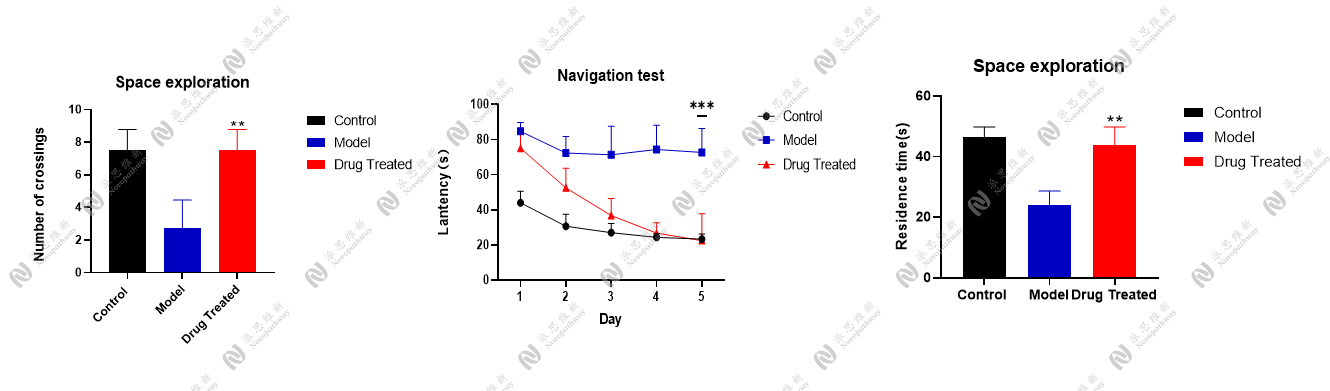
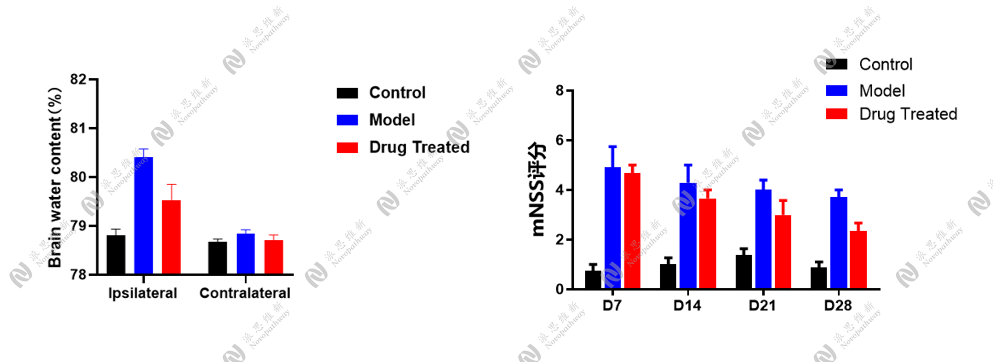
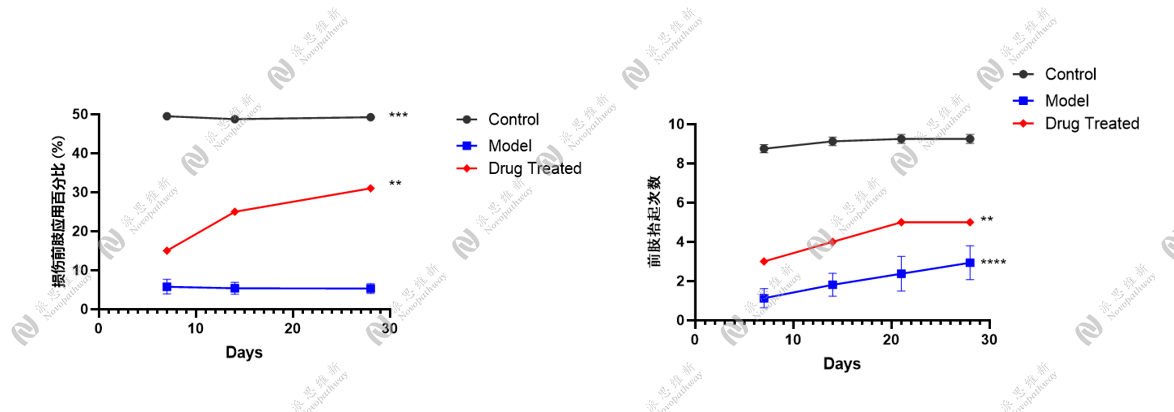
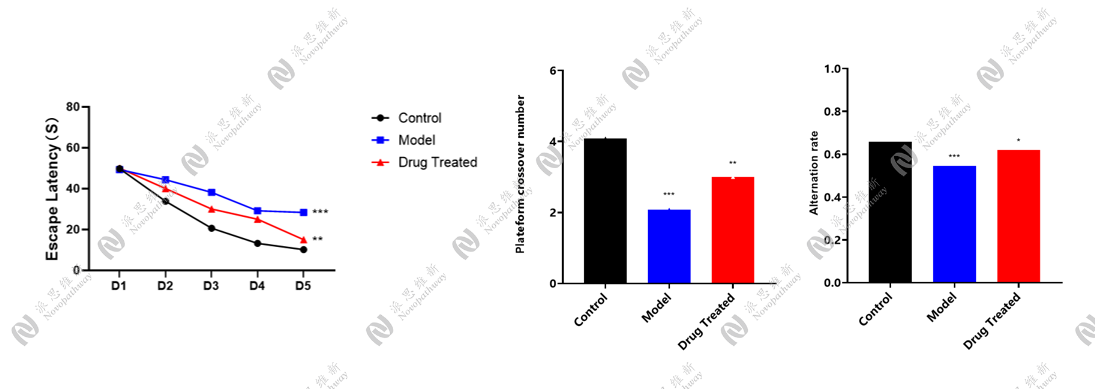
4.2.1 双侧海马定位注射STZ构建AD小鼠模型[3]
动物:28g C57BL/6小鼠 雄性 8-10周
试剂:链脲佐菌素STZ, 美国Sigma公司
注射坐标:(AP:-2.1 mm,MI:±1.3 mm, DV:-1.8 mm)
行为学检测:Morris水迷宫实验
参考文献
[1] Cook C, Kang SS, Carlomagno Y, Lin WL, Yue M, Kurti A, Shinohara M, Jansen-West K, Perkerson E, Castanedes-Casey M, Rousseau L, Phillips V, Bu G, Dickson DW, Petrucelli L, Fryer JD. Tau deposition drives neuropathological, inflammatory and behavioral abnormalities independently of neuronal loss in a novel mouse model. Hum Mol Genet. 2015 Nov 1;24(21):6198-212.
[2] Negrini M, Tomasello G, Davidsson M, Fenyi A, Adant C, Hauser S, Espa E, Gubinelli F, Manfredsson FP, Melki R, Heuer A. Sequential or Simultaneous Injection of Preformed Fibrils and AAV Overexpression of Alpha-Synuclein Are Equipotent in Producing Relevant Pathology and Behavioral Deficits. J Parkinsons Dis. 2022;12(4):1133-1153.
[3] 陈星星.白藜芦醇对海马内注射链脲佐菌素诱导的AD小鼠学习记忆缺陷的保护作用及部分机制研究[D].安徽医科大学,2020.
[4] 孙余明,楼建涛,黄光祥,等.注射用阿魏酸钠对胶原酶致大鼠脑出血模型的治疗作用及机制研究[C]//浙江省医学会神经病学分会.2011年浙江省神经病学学术年会论文汇编.杭州市萧山区第三人民医院神经内科;,2011:1.
[5] Park JH, Ju YH, Choi JW, Song HJ, Jang BK, Woo J, Chun H, Kim HJ, Shin SJ, Yarishkin O, Jo S, Park M, Yeon SK, Kim S, Kim J, Nam MH, Londhe AM, Kim J, Cho SJ, Cho S, Lee C, Hwang SY, Kim SW, Oh SJ, Cho J, Pae AN, Lee CJ, Park KD. Newly developed reversible MAO-B inhibitor circumvents the shortcomings of irreversible inhibitors in Alzheimer's disease. Sci Adv. 2019 Mar 20;5(3):eaav0316.
[6] Das AS, Regenhardt RW, Feske SK, Gurol ME. Treatment Approaches to Lacunar Stroke. J Stroke Cerebrovasc Dis. 2019 Aug;28(8):2055-2078.
[7] Zhang C, Li S, Wang Y, Shi J. Photochemically induced thalamus infarction impairs cognition in a mouse model. Stroke Vasc Neurol. 2023 Dec 29;8(6):444-452.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




