- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

肾衰竭
肾衰竭介绍
肾衰竭各种病因引起肾功能严重障碍时,人体内环境就会发生紊乱,其主要表现为代谢产物在体内蓄积,水、电解质和酸碱平衡紊乱,并伴有尿量和尿质的改变以及肾脏内分泌功能障碍引起一系列病理生理变化,称之为肾功能衰竭。根据发病的急缓和病程长短分为:急性肾功能衰竭(acute renal failure,ARF)和慢性肾功能衰竭(chronic renal failure,CRF)。
(一)急性肾功能衰竭动物模型ARF
急性肾功能衰竭(ARF)是指由于各种原因引起的双肾泌尿功能在短期内急剧障碍,导致代谢产物在体内迅速积聚,水、电解质和酸碱平衡紊乱,出现氮质血症和代谢性酸中毒,并由此发生的机体环境严重紊乱的临床综合征。目前使用的实验动物模型从机制上分为缺血性ARF模型和中毒性ARF模型。
1. 缺血性ARF模型
缺血性ARF模型是通过机械方法或者药物方法,造成肾脏缺血,最终导致肾小管上皮细胞损伤,从而使动物发生急性肾衰竭临床症状。制备缺血性ARF模型的方法包括: 血流阻断法、输尿管结扎法、缺血/再灌注法、低灌注法、甘油致法、油酸诱导法。
1.1 血流阻断法ARF模型
血流阻断法ARF模型制备方法:采用家兔进行全身麻醉,分离两侧肾动脉,并进行双侧肾动脉不完全结扎,造成急性肾缺血。阻断肾血流20min后,恢复肾脏血流再灌注,从而制备缺血性ARF模型。实验动物伴随着双侧肾动脉不全结扎,尿量明显减少,血清肌酐水平显著升高,血钾呈升高趋势,并出现代谢性酸中毒,符合ARF临床表现。
肾动脉血流阻断法建立的动物模型表现了功能性ARF的多重特点,且临床及病理上较易观察,从病因和对肾脏的损伤上也符合临床实际。是缺血性ARF模型常用的方法。
1.2 输尿管结扎法ARF模型
采用Wistar雄鼠进行麻醉后,游离肾脏和输尿管,结扎左侧输尿管。或者结扎豚鼠双侧输尿管制备ARF模型。大鼠在术后 14、21、28 天,模型组血清尿素氮和肌酐与假手术组比较,均有明显升高。术后 14天模型组大鼠结扎侧左肾体积扩大,大于对侧肾脏,肾盂和肾盏高度扩张。病理学检查显示肾小管呈囊性扩张,部分区域可见肾实质细胞明显减少,间质成纤维细胞大量增生,胶原纤维形成。
输尿管结扎,可造成尿路梗阻,肾盂积水,肾间质压力升高,肾小球囊内压升高,引起肾小球有效滤过压下降,从而导致ARF的形成。结扎输尿管造成的ARF动物模型,操作简单,费时短,创伤小。
1.3 缺血/再灌注致ARF模型
急性缺血/再灌注模型的制备方法:动物麻醉后切除右肾,钝性分离左肾动脉,用无创动脉夹夹闭左肾动脉45分钟,肾脏由鲜红色逐渐变为暗红色。然后松开动脉夹,肾脏逐渐转变为正常的红色,认为再灌注成功。肾缺血后由于灌注不足导致缺氧,代谢产物堆积,导致肾小管上皮细胞损伤,逐渐发展为细胞凋亡和坏死,既急性肾小管坏死,其基本的病理机制主要包括血管内皮细胞及平滑肌的损伤、炎症反应、氧自由基产生、补体免疫系统的激活、小管上皮细胞的损伤、间质纤维化的逐渐形成。
该模型采用外科手术使模型动物肾脏血供受阻,可用于探讨ARF发病机制及氧自由基清除剂对ARF防治作用方面的研究。
1.4 低灌注性ARF模型
低灌注性ARF模型通过部分结扎腹主动脉的方法,压迫腹主动脉,使肾脏持续低灌注、缺血,导致肾小管上皮细胞损伤,诱导产生ARF模型。由于肾脏的持续低灌注为临床上ARF常见诱发因素,而传统的肾动脉夹闭引起的肾缺血与持续低灌注致在发病机制上存在差异,因此,该方法建立的低灌注模型具有重要的临床意义。
1.5 甘油致ARF模型
甘油致ARF模型制备方法:
① 采用日本大耳白兔肌肉注射 50% 甘油(10ml/kg) 的方法诱导形成ARF模型。模型组血 Cr、BUN 均高于同时间点正常对照组( P<0.01),病理学检查可见肾小管上皮细胞肿胀,部分管腔闭塞、坏死等病理改变。
② 采用SD大鼠,禁水24h,体重减轻10%的大鼠肌肉注射50%甘油生理盐水( 10 ml/kg) 制备ARF模型。模型组大鼠注射甘油生理盐水1小时后可见肾小球轻微充血肿胀,24小时可见肾小球系膜细胞肿胀、空泡变性,大量近端小管和远端小管上皮细胞坏死、崩解。24 小时血肌酐(Cr) 、尿素氮(BUN) 及磷酸肌酸激酶(CK)均明显高于对照组( P<0.01)。
制备原理:甘油作为高渗性物质,局部肌注后,局部肌肉变性坏死及血管内溶血,释放肌红蛋白和血红蛋白,二者可使肾血管收缩,肾小球出入球小动脉均发生收缩,导致肾血流量和肾小球滤过率下降,引起肾脏缺血而使肾小管受到损害,导致肾小管损伤。同时,肌红蛋白和血红蛋白可分解为高铁血红素,对肾小管产生毒性作用。
甘油诱导的ARF模型,兼有肾缺血及内源性毒性物质对肾脏损伤的双重作用,且该模型制备简单易操作,模型稳定,动物存活率高。
1.6 油酸诱导ARF模型
模型制备采用Wistar雄鼠,通过左肾动脉注射油酸(0.15ml/kg) 的方法制备ARF模型。模型组注射油酸后24小时,病理检查显示: 肾小球毛细血管内皮细胞核固缩、核碎裂、核溶解,线粒体肿胀空化,内质网扩张,内皮细胞崩解,基底膜部分破坏、消失。
制备原理:油酸是一种具有较强毒性作用的脂肪酸,左肾动脉注射油酸后,引起肾小管上皮细胞肿胀、坏死,间质水肿,肾内血管缺血,肾微循环严重障碍,肾脏排泄功能衰竭,形成ARF。此动物模型适合于肾微循环的研究,模拟人类起源于肾微循环障碍的缺血性ARF,为了解ARF时肾微循环的改变提供了有效载体。
动物种属:小鼠、大鼠、豚鼠、家兔
2. 中毒性ARF模型
中毒性ARF模型是通过肌肉、静脉或者腹腔注射的方式,将具有肾毒性的试剂注入实验动物体内,在体内经过一系列代谢最终蓄积于肾小管上皮细胞。由于其细胞毒性效应,最终导致肾小管上皮细胞损伤及坏死,诱导产生ARF。 制备中毒性ARF模型的方法包括: 顺铂诱导法、氨基糖苷类诱导法、内毒素介导法。
2.1 顺铂诱导ARF模型
顺铂诱导的ARF模型采用一次性注射大剂量顺铂的方式,可以诱导急性肾损伤动物模型,表现为肾衰竭,肾小球上皮细胞水肿、坏死和脱落等病理改变。
制备原理:顺铂肾毒性可导致肾小管细胞死亡,包括细胞坏死与凋亡,高浓度导致肾小管细胞坏死,低浓度诱导细胞凋亡。
顺铂诱导的ARF模型被认为是较为典型的急性肾小管坏死模型,此类模型可用于顺铂肾毒性作用机制及相关防治措施的研究。
2.2 氨基糖苷类诱导ARF模型
氨基糖苷类诱导ARF模型采用Wistar雄鼠,腹腔注射庆大霉素140mg/kg,连续注射7天,建立庆大霉素ARF模型。模型组大鼠 24小时尿量、尿NAG酶活性、Scr和 BUN 均有明显升高。
制备原理:利用庆大霉素等氨基糖苷类抗生素进入人体后,在肾小管蓄积,造成肾小管上皮细胞及溶酶体等微细胞器的功能障碍,最终导致肾小管损伤,发生急性肾功能衰竭。
急性肾小管坏死是ARF的主要病因。氨基糖苷类诱导的ARF模型,是当今公认的肾毒性ARF实验模型,能很好地模拟肾小管坏死造成的急性肾衰竭,适用于急性肾小管坏死机制、防治肾小管坏死以及氨基糖苷类抗生素致ARF的药物防治方面的实验研究。
2.3 内毒素介导ARF模型
内毒素介导ARF模型制备方法:
① 采用家兔一次性静脉注射大肠杆菌O111B4 内毒素生理盐水溶液(100㎍/kg) ,测定肌酐、尿素氮、肾衰指数、钠排泄率和内生肌酐清除率等肾功能指标,显示该试验动物模型发生严重肾功能衰竭。
② 采用C57BL/6小鼠一次性腹腔注射大肠杆菌内毒素脂多糖(LPS) 15mg/kg的方法制备内毒素型ARF模型。肾功能及肾脏病理检测显示,模型组小鼠肌酐、尿素氮值均明显升高,肾组织出现肾小管扩大、空泡形成等病理改变。
制备原理:内毒素可引发弥漫性血管内凝血,而肾小球毛细血管内广泛形成的微血栓阻断了肾小球毛细血管血流,从而导致肾小球滤过率降低,这是内毒素介导急性肾功能衰竭的首要机理。
内毒素性急性肾衰竭是目前感染性休克患者死亡的原因之一,目前临床仍旧缺乏有效的药物进行治疗,因此,此类模型的成功应用,对于内毒素性急性肾衰竭的机理研究、治疗药物的研发等方面都有积极意义。
2.4 氯化汞诱导ARF模型
氯化汞诱导ARF模型采用道家兔肌肉加压注射1%氯化汞1ml/kg, 造模24h,测定Cr、BUN、MDA含量、SOD活力及肾脏病理检测,结果表明造模成功,动物形成ARF。
制备原理:汞离子经肾小球率过后被肾小管上皮细胞重吸收,并在细胞内积聚,与细胞内的巯基和二硫基等结合,影响细胞酶活性,并使蛋白质凝固,造成重金属盐导致的中毒性肾小管损伤,临床出现ARF。
氯化汞诱导ARF模型是重金属致急性肾小管坏死病变的典型模型,并且适用于大鼠和小鼠。但是氯化汞属于强肾毒性物质,剂量掌握不当就会造成实验动物的死亡,而汞离子对机体的伤害不仅仅局限于肾脏,还会影响机体的其他组织器官。
动物种属:小鼠、大鼠、家兔
(二)慢性肾功能衰竭动物模型CRF
慢性肾功能衰竭( CRF) 是一种常见的临床综合征,它由各种原因引起肾脏损害并进行性恶化、造成肾单位严重破坏、肾实质不可逆性逆转的损害,致使机体在排泄代谢产物和调节水电解质及酸碱平衡等方面发生紊乱。目前使用的实验动物模型主要可分为肾毒性CRF模型和肾切除CRF模型。
1. 肾毒性CRF模型
肾毒性CRF模型通过肌肉、静脉或者腹腔注射的方式,将具有肾毒性的试剂注入实验动物体内,在体内经过一系列代谢最终蓄积于肾脏不同部位。由于其细胞毒性效应,引起肾脏组织的病理改变。肾脏的实质损害,随病程进展,逐步诱导产生CRF。肾毒性CRF模型主要包括: 嘌呤霉素模型、阿霉素模型、 腺嘌呤模型。
1.1 嘌呤霉素CRF模型
嘌呤霉素模型原理:嘌呤霉素氨基核苷(PAN) 对肾脏足细胞具有特异性损害,可以引起足细胞的损伤和凋亡,并损害肾小球滤过膜的负电荷屏障,导致肾小球滤过屏障受损,产生大量蛋白尿。随着病程的进展,形成微小病变肾病(MCNS) 和局灶节段性肾小球硬化(FSGS)样病变,最终诱发CRF的形成。
PAN肾病大鼠模型,临床主要表现为大量蛋白尿,给药方式包括皮下注射、腹腔注射、尾静脉注射和颈静脉注射四种。PAN肾病动物模型,由于其临床及病理表现特异、造模方法简单,是研究MCNS和FSGS病理损害、发生机制及药物干预等的理想实验动物模型。
1.2 阿霉素CRF模型
阿霉素(Adriamycin,ADR) 具有肾毒性,可使肾脏近曲小管上皮细胞受损,脱落的小管上皮细胞与管腔内的蛋白质及其他细胞成分构成管型,堵塞管腔,引起肾小管内压增高,加重肾损伤,最终形成CRF。目前多采用静脉注射阿霉素和单侧肾摘除加术后尾静脉注射阿霉素的方法制备CRF模型。
阿霉素肾病模型可用于改善蛋白尿、低蛋白血症,降低肾小管压力以及减轻肾小管上皮细胞损伤的药物开发、机制研究及药效学研究。研究人员应根据自身需求,合理选择的建立方法。
1.3 腺嘌呤CRF模型
腺嘌呤通过黄嘌呤氧化酶的作用生成极难溶于水的2,8-二羟基腺嘌呤,后者沉积于肾小球和肾间质部位逐渐形成肉芽肿并发生炎症反应,堵塞肾小管腔而引起相应的肾小管腔呈囊状扩张。由于肾小管的堵塞,引起肾小管梗阻,影响氮质化合物的排泄,导致氮质血症,毒素蓄积及电解质和氨基酸代谢紊乱,随病程进展,肾单位大量丧失进而导致肾功能衰竭。
腺嘌呤剂量的大小和摄入时间的长短是模型制备的关键因素。模型制作采用250mg/kg/d腺嘌呤灌胃5周可成功构建以肾间质纤维化为主,由轻到重逐渐进展且具备多种并发症的慢性肾功能衰竭大鼠模型。
2. 肾切除CRF模型
实验动物进行肾脏部分切除手术后,残存的肾单位出现高灌注、高滤过和高压力,进而导致肾小球硬化和剩余肾单位的进一步破坏,最终发展为慢性肾衰竭。5/6肾脏切除法(5/6 nephrectomy,5/6NX)是目前制备CRF模型较为经典的外科手术方法。
将 SD大鼠、C57小鼠麻醉后,于左肋下25px处行一斜向外下方切口(小鼠:0.8-25px,大鼠:1-37.5px),切口约与鼠体长纵轴向内成45度角,暴露左侧肾脏,分离肾周围脂肪并剥离肾外包膜后切除上下极组织各1/3,用明胶海绵压迫止血10min后复位肾脏并缝合。1周后行2期手术,同样手法麻醉,切开右背暴露右肾,结扎肾蒂后切除整个右肾。两次手术共切除约70%肾脏。
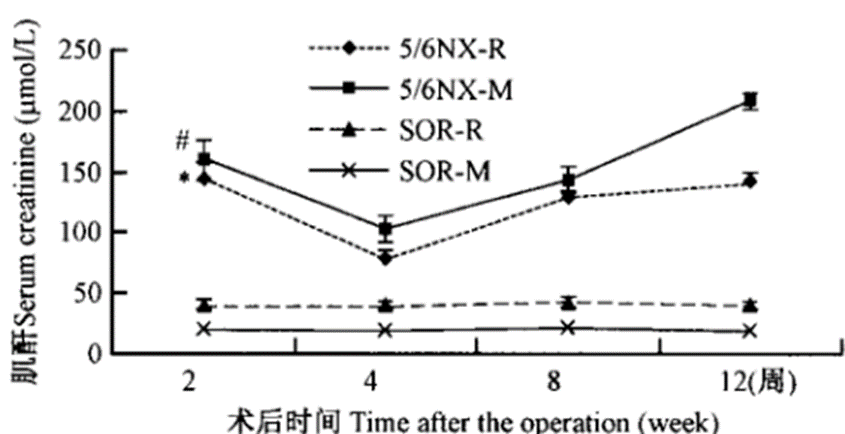
肾切除CRF模型能成功模拟人慢性肾衰的病理发生发展过程,研究发现发现5/6肾切除后,系膜细胞和系膜基质增生,肾小球硬化,肾小管灶状萎缩,间质纤维化,表现出与人类肾脏纤维化相一致的病理过程。
动物种属:小鼠、大鼠
检测指标
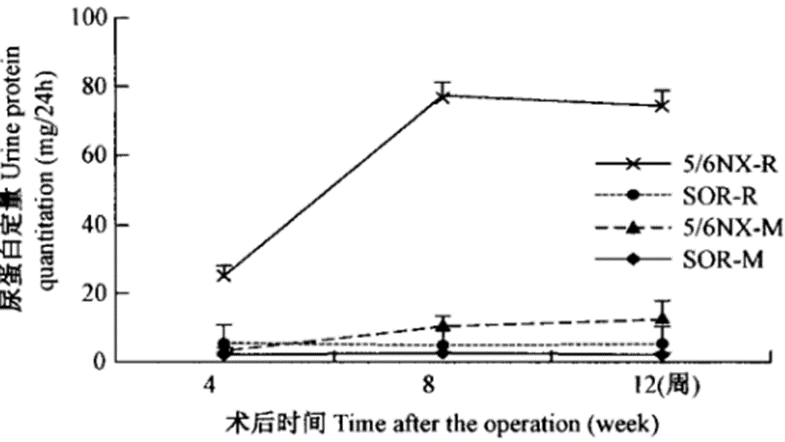
(1)肾功能、尿蛋白定量检测;
(2)病理组织学检测;
(3)免疫组化;
案例展示
肾切除CRF模型
|
|
图1 各组大小鼠肌酐变化趋势 | 图2 各组大小鼠24h尿蛋白定量变化趋势 |
注:与大鼠假手术组比较,*P<0.05;与小鼠假手术组比较,*P<0.05;
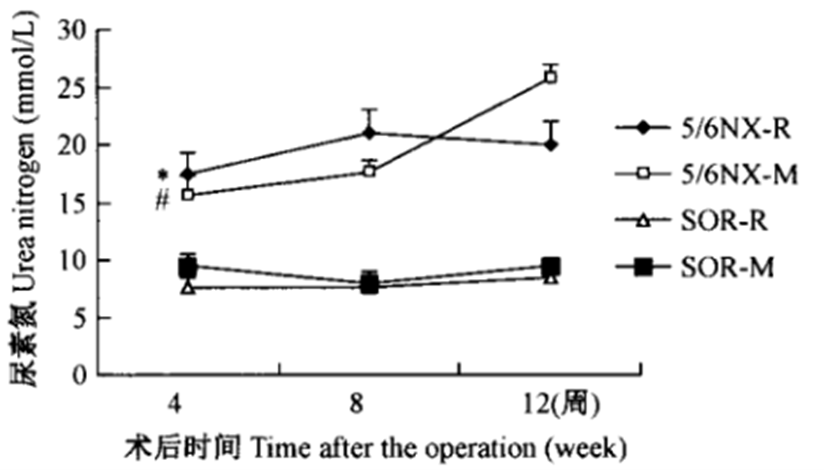
图3 各组大小鼠尿素氮变化趋势
注:与大鼠假手术组比较,*P<0.01;与小鼠假手术组比较,*P<0.01;
参考文献
1. 何鹏飞, 高敏, 张娅. 急慢性肾衰竭动物模型研究进展[J]. 云南中医重要杂志 2017年38卷12期, 80-84页.
2. 张德志, 李前勇. 急性肾衰竭动物模型建立方法的研究进展[J]. 畜牧业杂志 2008年10月234期, 22-24页.
3. 陶琦, 姚源璋. 急性肾衰竭动物模型研究进展[J].中国中西医结合肾病杂志 2013年7月第14卷7期, 654-655页.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501
北京阳光诺和药物研究股份有限公司
办公地址:北京市昌平区双营西路79号院7号楼
总公司网址:http://www.sun-novo.com