- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

肝损伤
肝损伤疾病介绍
肝脏是人体最大的实质性器官,被称为“人体的综合化工厂〞在人体中主要发挥着以下几点作用:
1. 新陈代谢作用:例如糖代谢:合成,分解肝糖原;蛋白质代谢:白蛋白合成器管,血浆蛋白主要合成场所;脂肪代谢:脂肪合成与释放;维生素代谢:95%维生素A储存在肝脏;激素代谢:参与激素灭活。
2. 解毒免疫:人体主要解毒器官,使毒物转化为无毒或溶解度大的物质排出体外;代谢废物和毒物在肝脏解毒;最大网状内皮吞噬系统,清除抗原。
3. 胆汁分泌:胆汁酸的生成和排泄;肝细胞制造、分泌的胆汁经由胆管输送到胆囊,胆囊浓缩后进入小肠,帮助脂肪的消化和吸收。
4. 凝血,水、电解质平衡等作用。
肝脏作为人体最大的解毒器官,对机体起着重要的保护作用。当肝脏受到损伤时,它的功能也会受到严重影响,导致过多的脂肪和有毒代谢物等的堆积,造成肝纤维化、肝衰竭等症状,甚至更严重的肝癌。
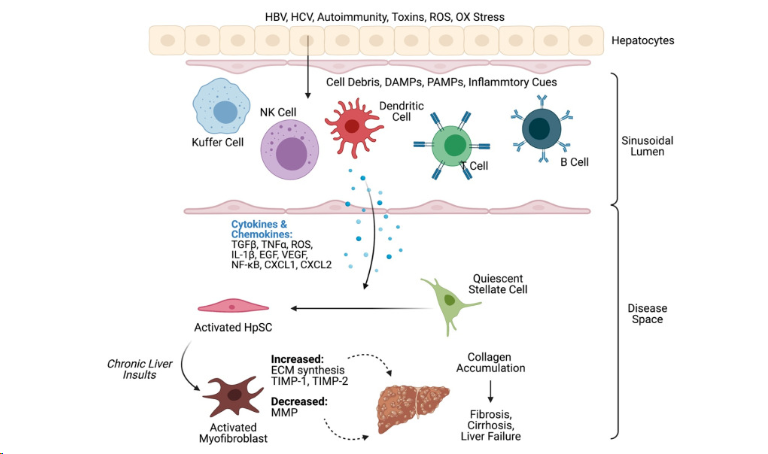
图1:肝纤维化、肝硬化和肝衰竭背后的免疫机制示意图
肝脏受损后,肝脏疾病发展的几个阶段如下:
1. 炎症:机体检测到炎症诱导物后,免疫及炎性细胞通过特异性模式识别受体而激活,释放炎症因子来消灭损伤因子。
2. 纤维化:持久的炎症反应或肝炎不断的使修复细胞持续的分泌胶原蛋白,更多的胶原蛋白沉积,形成疤痕组织。
3. 肝硬化:当纤维化进展严重后,肝脏受到严重的损伤和永久性破坏,肝再生功能丧失无法自我修复。
导致肝损伤的因素有很多,主要有以下几点:抗结核药物引起药物性肝损伤、酗酒引起的酒精性肝损伤、化学试剂引起的化学性肝损伤。建立肝损伤动物模型是研究肝损伤机制和寻找治疗肝损伤药物的一个重要方法。本文总结了几个肝损伤动物模型的造模方法,为进一步研究肝损伤提供途径。
四氯化碳诱导急性肝损伤模型
机制:CCL4为一种选择性肝毒性药物,其进入机体后在肝内活化成自由基如三氯甲基自由基(CCl3),后者可直接损伤质膜,启动脂质过氧化作用,破坏肝细胞的膜性结构等,造成肝细胞变性坏死和肝纤维化的形成。
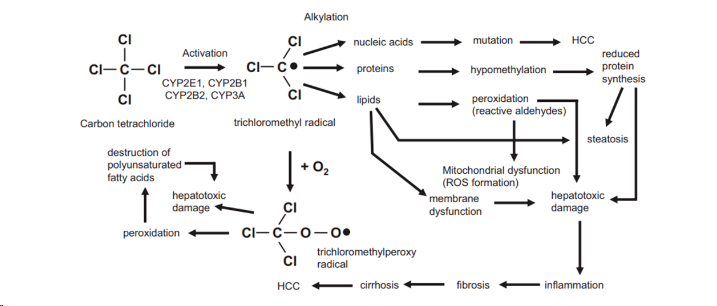
图2:CCL4致病机制
方法:通过CCl4复制肝纤维化模型通常以小鼠或大鼠作为选用对象,造模途径主要为给予小鼠CCl4腹腔注射处理(CCl4 0.15ml/kg,每周两次),连续4-8周,造模的体积为10ml/kg。腹腔注射不同浓度的四氯化碳可以建立急性肝损伤的动物模型。
对乙酰氨基酚诱导急性肝损伤模型
机制:对乙酰氨基酚(APAP)的毒性与肝内代谢有关。在肝内,少量APAP可以被CYP2E1酶降解为高毒性的活性代谢物N-乙酰-对-苯醌亚胺(NAPQI)。少剂量的NAPQI可以被线粒体中的内谷胱甘肽(GSH)解除毒性。对乙酰氨基酚诱导小鼠肝损伤的机制为当APAP过量时,其代谢过程产生大量的NAPQI,超过了GSH的解毒能力,未被清除的NAPQI与细胞内线粒体结合,破坏线粒体膜并最终导致肝细胞坏死。
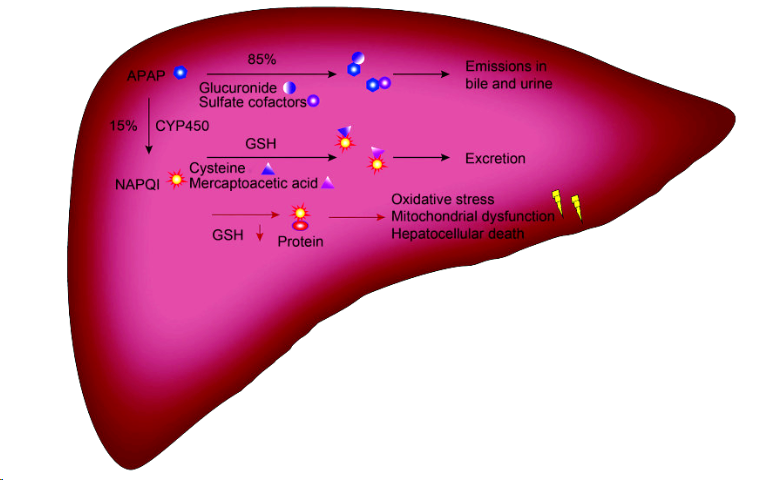
图3:APAP代谢示意图
方法:在末次给药12h后,对小鼠腹腔注射300mg/kg APAP溶液进行造模。在末次给药30min后对大鼠皮下注射450mg/kg APAP溶液制造大鼠急性肝损伤模型。
刀豆蛋白A (ConA)诱导肝损伤模型
机制:ConA诱导小鼠肝损伤的机制为刀豆蛋白与肝窦内巨噬细胞结合,使T淋巴细胞进入肝窦,释放炎性介质,损伤肝细胞。肝细胞膜被破坏,肝细胞内ALT、AST大量进入血液,ALT、AST浓度随着ConA剂量的增加而升高。
方法:采用ConA以10mg/kg(1g/LPBS溶液)对小鼠进行尾静脉注射,每周1次,连续注射4周,制造小鼠慢性肝损伤模型。或者采用5mg/kg ConA对小鼠进行尾静脉注射,隔天1次,共两周,诱发小鼠肝损伤模型。
抗结核药物(异烟肼联合利福平)诱导肝损伤模型
机制:异烟肼可以降低甚至抑制线粒体呼吸链中酶的活性。打破线粒体的正常功能,使线粒体损伤,干扰细胞能量代谢,导致细胞凋亡。通过激活死亡因子受体(Fas)介导的死亡通路,诱导肝细胞大量凋亡,肝细胞内的ALT和AST大量入血,血液中转氨酶活性上升。
方法:用异烟肼+利福平各50mg/kg给大鼠口服给药,建立大鼠的肝损伤模型。或者通过给予成年大鼠55mg/kg的异烟肼药物1次/d,连续给药 28d,建立大鼠肝损伤模型。
酒精诱导肝损伤模型
机制:酒精在肝脏内的代谢可产生大量自由基。过量的自由基可氧化生物膜脂质,破坏线粒体膜和肝细胞膜,导致ALT和AST大量入血。检测酒精性肝损伤的指标有丙二醛(MDA)、GSH、血清超氧化物歧化酶(SOD)、三酰甘油(TG)。乙醇在乙醇脱氢酶的作用下转化为乙酸,抑制三羧酸循环,导致脂肪堆积,肝组织TG指标上升。
方法:用5g/kg酒精给小鼠灌胃,或者在末次给药后2h,给小鼠灌胃15ml/kg白酒,每12h灌胃1次,一共两次造模,建立小鼠急性肝损伤模型。用0.7ml/100g 30%的乙醇每日定时给大鼠灌胃,或者用40%-50%梯度乙醇浓度0.5-1ml/100g的乙醇对大鼠进行灌胃,来建立大鼠酒精性慢性肝损伤的模型。
派思维新抑郁症模型案例分享
CCL4 induced liver fibrosis model
Animal:C57BL/6 mice, 6-8 week
Serum biochemical:ALT, AST, TBIL
Pathologic analysis in liver:H&E,Sirius red
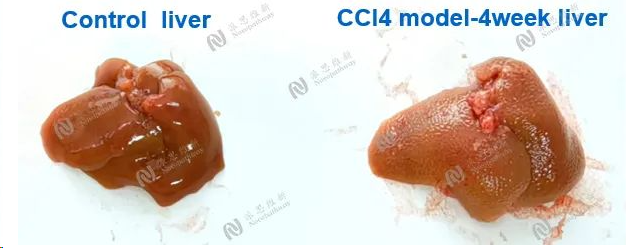
图4:CCL4诱导肝纤维化4周肝脏病变情况
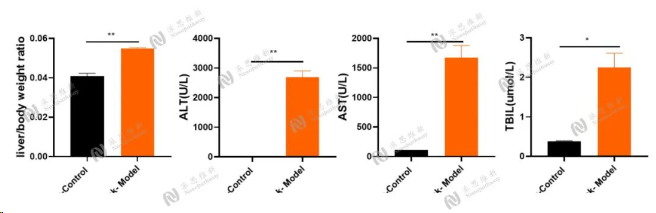
图5:CCL4造模8周血生化和肝指数结果
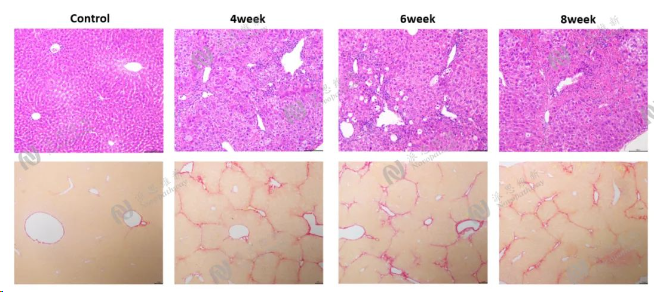
图6:CCL4造模后肝组织各周期病理H&E和Sirius red染色结果图
Bile duct ligation model
Animal:C57BL/6 mice, 7-8 week
Pathologic analysis in liver:H&E, Sirius red
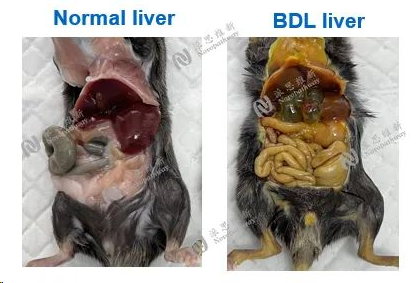
图7:胆管结扎诱导肝纤维化肝脏病变图
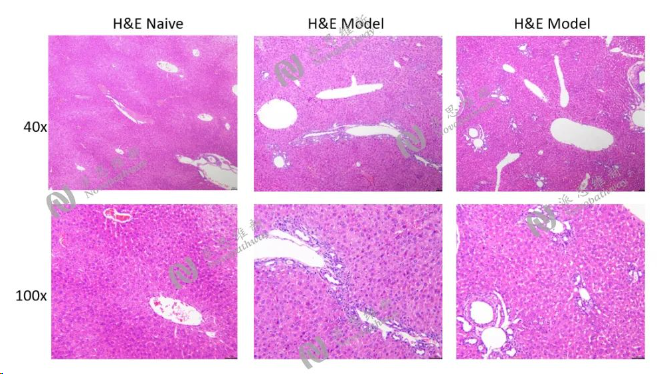
图8:胆管结扎模型肝组织病理H&E染色结果图
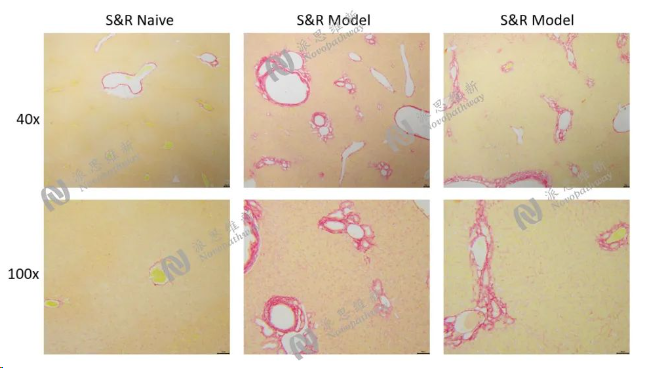
图9:胆管结扎模型肝组织病理Sirius red染色结果图
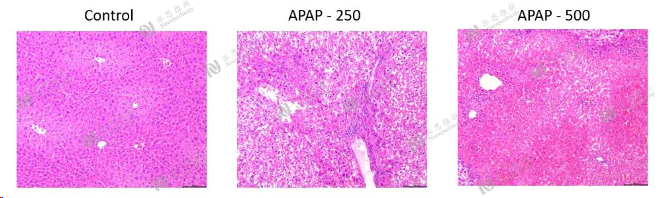
APAP induced acute liver injury model
Animal:C57BL/6 mice, 6-8 week
Serum biochemical:ALT, AST
Pathologic analysis in liver:H&E
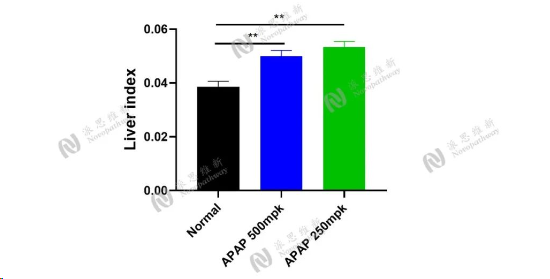
图10:APAP诱导急性肝损伤肝组织肝指数结果图
Alcohol induced chronic liver injury model
Animal:SD rat, male, 8-9 week
Serum biochemical:ALT, AST, TG
Pathologic analysis in liver:H&E
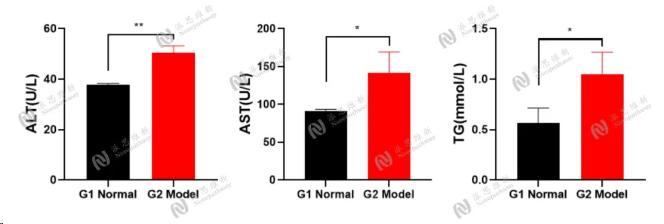
图12:酒精诱导慢性肝损伤模型8周血生化结果
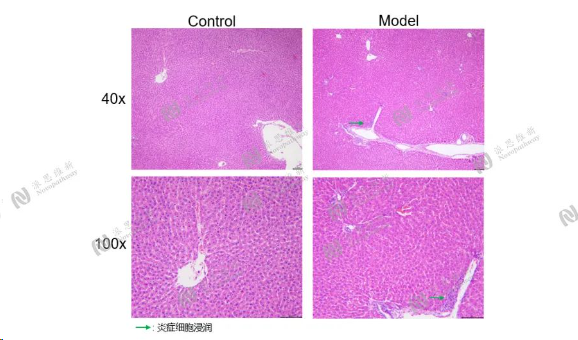
图13:酒精诱导慢性肝损伤肝组织病理H&E染色结果图
参考文献
[1]: Neshat SY, Quiroz VM, Wang Y, Tamayo S, Doloff JC. Liver Disease: Induction,Progression, Immunological Mechanisms, and Therapeutic Interventions. Int J MolSci. 2021 Jun 24;22(13):6777. doi: 10.3390/ijms22136777.
[2]:Scholten D, Trebicka J, Liedtke C, Weiskirchen R. The carbon tetrachloride model in mice. Lab Anim. 2015 Apr;49(1 Suppl):4-11. doi:10.1177/0023677215571192.
[3]: Cai X, Cai H, Wang J, Yang Q, Guan J, Deng J, Chen Z. Molecular pathogenesis of acetaminophen-induced liver injury and its treatment options. J Zhejiang Univ Sci B. 2022 Apr 15;23(4):265-285. English. doi: 10.1631/jzus.B2100977.
[4]: Caligiuri A, Gentilini A, Pastore M, Gitto S, Marra F. Cellular and Molecular Mechanisms Underlying Liver Fibrosis Regression. Cells. 2021 Oct 15;10(10):2759. doi: 10.3390/cells10102759.
[5]: Lai M, Afdhal NH. Liver Fibrosis Determination. Gastroenterol Clin North Am. 2019 Jun;48(2):281-289. doi: 10.1016/j.gtc.2019.02.002. Epub 2019 Apr 1.
[6]: Kisseleva T, Brenner D. Molecular and cellular mechanisms of liver fibrosis and its regression. Nat Rev Gastroenterol Hepatol. 2021 Mar;18(3):151-166. doi:10.1038/s41575-020-00372-7. Epub 2020 Oct 30.
[7]:Roehlen N, Crouchet E, Baumert TF. Liver Fibrosis: Mechanistic Concepts andTherapeutic Perspectives. Cells. 2020 Apr 3;9(4):875. doi: 10.3390/cells9040875.
[8]:Aydın MM, Akçalı KC. Liver fibrosis. Turk J Gastroenterol. 2018Jan;29(1):14-21. doi: 10.5152/tjg.2018.17330.
[9]: Ezhilarasan D. Molecular mechanisms in thioacetamide-induced acute and chronic liver injury models. Environ Toxicol Pharmacol. 2023 Apr;99:104093. doi:10.1016/j.etap.2023.104093.
[10]:张守堂,万国靖,李璐. 药物性肝损伤机制的研究进展[J]. 药学服务与研究,2017,17(1):39-42. DOI:10.5428/pcar20170113.
[11]:韩玉梅,鄢丹,胥秀英,等. 肝脏疾病动物模型的分类与应用[J]. 中药材,2010,33(4):644-647.
[12]:徐博, et al."肝损伤动物模型的研究进展." 中国当代医药 26.14(2019):38-40+44.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501
北京阳光诺和药物研究股份有限公司
办公地址:北京市昌平区双营西路79号院7号楼
总公司网址:http://www.sun-novo.com




