- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

世界骨质疏松日丨人未老骨先衰?共同关注骨骼健康
骨质疏松疾病介绍

骨质疏松症(Osteoporosis,OP)是一种以全身性骨量减少、骨微结构损坏,导致骨脆性增加、易于发生骨折为特征的全身性骨代谢疾病。随着世界人口老龄化日趋严重,骨质疏松症已成为重要的公共健康问题,全世界可统计的骨质疏松症患者超过2亿人,其在老年性疾病、代谢性疾病中发病率非常高,已跃居至世界上最常见疾病的第7位,严重威胁着老年人的生命健康,又被称为“静悄悄的流行病”、是吞噬老年人健康的“隐形杀手”。
现代医学将骨质疏松症分为原发性、继发性和特发性三大类。第一类原发性骨质疏松症(primary osteoporosis,POP),因增龄所致的体内性激素突然减少及生理性退行性改变所致,包括Ⅰ型绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)和Ⅱ型老年性骨质疏松症。第二类为继发性骨质疏松症,由疾病或药物因素诱发,如内分泌代谢病(糖尿病、甲状腺功能亢进症等)、肾脏疾病、肝脏疾病等。药物诱发如长期大剂量糖皮质激素的应用、肝素、免疫抑制剂等的应用。第三类为特发性骨质疏松症,多见于青少年,一般伴有遗传疾病史,女性多见,妇女哺乳期和妊娠期的骨质疏松症也往往列入此类。
由于骨质流失是隐匿的,骨质疏松症最初是无症状的,通常只有在第一次临床骨折发生后才能被诊断出来。其最常见的症状是疼痛,以腰背痛最为多见,其次是身长缩短、驼背,严重者可见骨折,常见部位为髋部、脊柱、腕部和肋骨[1]。
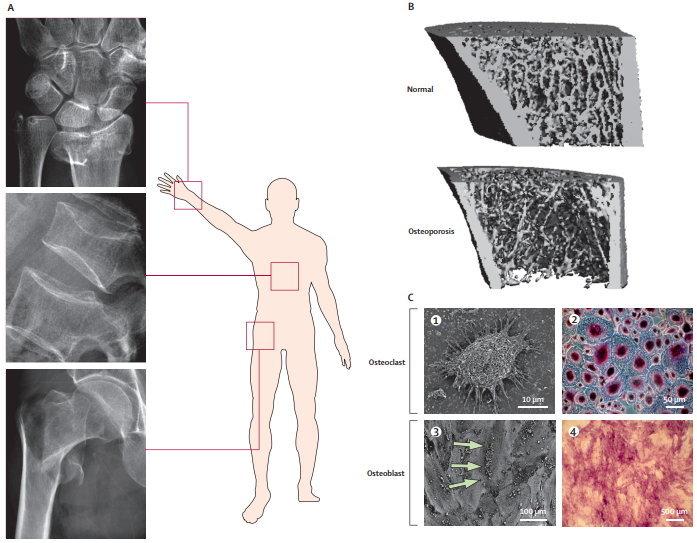
OP病因及发病机制
OP发生机制主要是增龄(衰老)、体内性激素减少、药物和某些疾病等因素导致骨吸收与骨形成失调,骨矿物质和有机质等比例丢失,导致骨量减少和骨质疏松,进而易发生骨折。机体的骨量多少是由成骨细胞和破骨细胞功能的平衡决定的,成骨细胞形成新骨,破骨细胞造成骨吸收。当成骨细胞活性大于破骨细胞活性时,新骨形成大于骨吸收,骨量增加,反之骨量减少。OP形成的机制即破骨细胞活性相对增加,导致形成骨吸收大于骨形成的负平衡状态,从而使机体骨量减少、骨小梁结构破坏,骨组织生物力学性能减低、易于发生骨折。
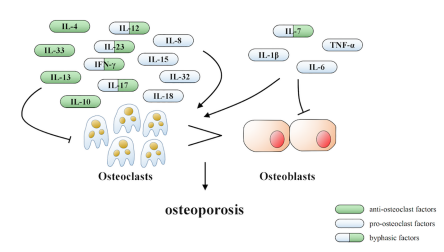
OP模型
骨质疏松症的病因和发病机制复杂,至今尚未完全明了,根据已了解的病因和发病机制,建立合适的、能反映疾病病理特征的动物模型,是研究不同途径药物抗OP药效学的关键。人类骨质疏松症是由于衰老进程(妇女绝经、老年退行性病变)及内分泌紊乱、营养不良、疾病及药物诱发等因素引起,针对以上因素,研究人员成功构建多种经典的、受到广泛认可的OP动物模型。目前常用来诱导OP的动物有大鼠、小鼠、 兔、羊、猪、狗和非人类灵长类动物以及斑马鱼等,造模方法有去势法(双侧卵巢切除、双侧睾丸切除等)、药物致骨质疏松法(糖皮质激素、维甲酸诱导等)、营养法(低钙饮食、低钠诱导等)、失用法(机械固定法,悬吊法等),以及一些特殊类型的造模方法如基因法(α,β-雌激素受体或芳香酶基因敲除)、脑源性造模法(破坏大鼠下丘脑弓状核)等,有的用单一种方法,有的两种或多种方法联合使用(去卵巢联合糖皮质激素、糖皮质激素法联合低钙饮食等)。
常见OP动物模型
1、手术去势法诱导绝经后骨质疏松症(PMOP)模型:
首次运用手术去势法可追溯到1969年,国外学者Saville采用手术方式摘除大鼠的双侧卵巢(OVX)后成功诱导OP症状,至此手术去势法构建PMOP动物模型得到广泛的认可及推广。目前去卵巢造模方法被广泛认为是绝经后骨质疏松症造模的金标准,也是FDA和WHO推荐的研究绝经后骨质疏松症模型。
造模方法:手术切除大鼠双侧卵巢,大鼠切除卵巢后14 d 胫骨近心端骨量丢失最明显,30 d 时股骨颈骨骨量丧失最多,60 d时腰椎椎骨骨量丢失达到高峰。切除雌性大鼠双侧卵巢造成雌激素水平急剧下降、骨量大量丢失而建立OP模型,具有建模因素单一、建模成功率高、可重复性好、可信度高和能够很好地体现雌激素水平下降这一重要病理生理现象等优点[3,4]。
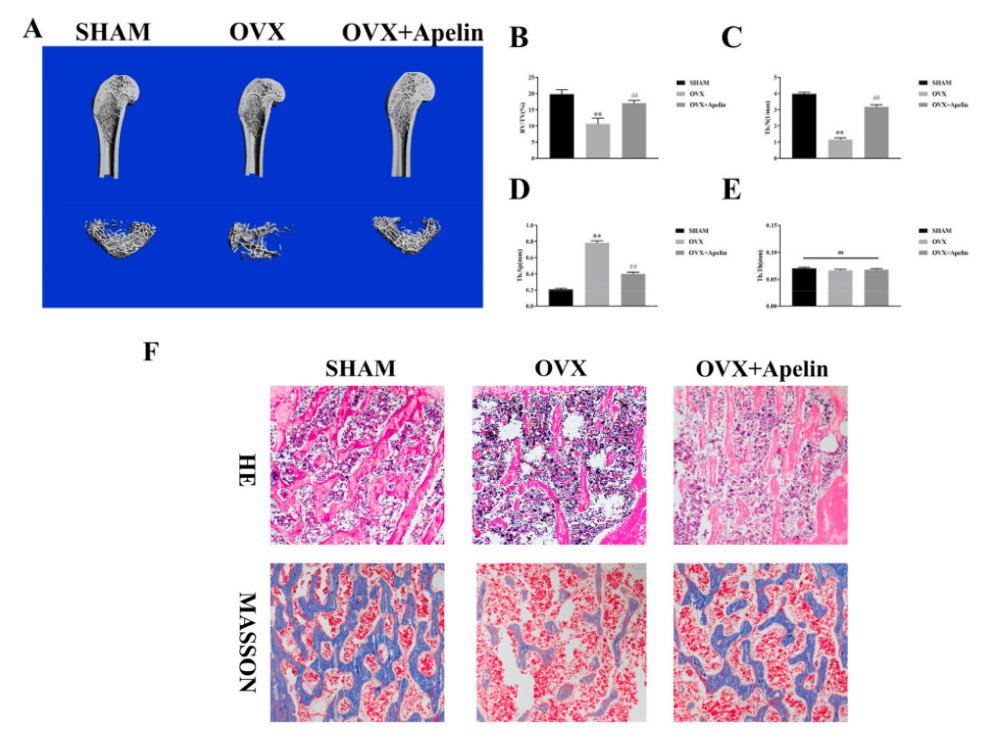
2、老年性骨质疏松症模型:
老年性骨质疏松症是由于年龄的老化引起的骨质疏松症。因此,可根据实验动物的寿命,采用自然衰老动物、快速老化模型小鼠(senescence -accelerated mouse,SAM)模拟老年性骨质疏松模型。快速老化模型小鼠SAMP6为自发老年性骨质疏松症模型,它是目前仅有的一种能证明增龄性骨脆性骨折的动物。SAMP6在4月龄时骨量达到峰值,之后骨量逐渐丢失,骨强度降低,硬度加大,抗变形能力及抗骨折能力差,与老年性骨质疏松症患者的病理变化相似。
3、药物诱导的骨质疏松症模型
① 糖皮质激素诱导的继发性骨质疏松(GIOP)模型[5-8]:
药物致骨质疏松模型中糖皮质激素(Glucocorticoids,GCs)应用最广泛,使用糖皮质激素引起的骨质疏松症发病率仅次于绝经后骨质疏松和老年性骨质疏松,己被列为导致骨质疏松症的三大诱因之一。GCs是治疗炎症性和风湿性疾病广泛使用的药物,在临床上,患者使用GCs后,会发生一定几率的骨质疏松症。一般认为其病理机制主要在于GCs能通过氧化还原的途径影响破骨细胞和成骨细胞的分化和寿命,激活RANKL/RANK和WNT/-β Catenin途径,从而抑制成骨细胞的增殖和分化、促进骨吸收和局部细胞凋亡,增加骨脆性和骨折的概率,导致继发性骨质疏松甚至骨坏死。因此,GCs诱导法建立的OP模型对研究人类骨质疏松症意义重大,最常用的糖皮质激素有地塞米松、氢化可的松和泼尼松龙。
造模方法:在大鼠身上使用超生理剂量的皮质类固醇激素,如大鼠灌胃醋酸泼尼松龙(2.7 mg/kg/d)4周,即可使骨代谢处于负平衡状态,即骨吸收大于骨形成,骨量不断丢失,进而成功构建骨质疏松动物模型。
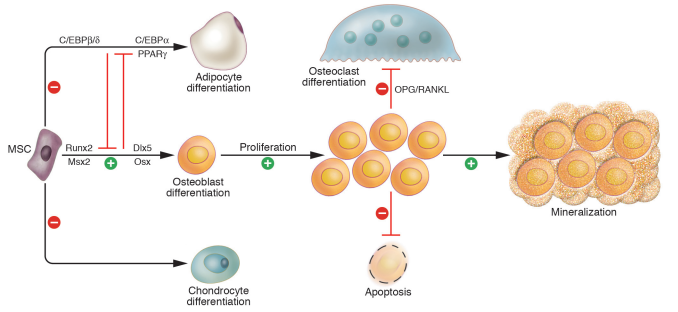
② 维甲酸诱导的继发性骨质疏松模型[9,10]:
维甲酸是治疗恶性肿瘤的药物,其副作用是引起骨量流失,诱发骨质疏松。研究发现维甲酸连续注射两周,动物即可出现严重的骨质疏松表现,骨量丢失,骨生物力学性能下降等。一般认为其作用机理主要是过激活体内的维甲酸受体相关的孤儿受体(ROR)进而影响骨代谢,使骨重建处于骨吸收大于骨形成的负平衡状态,从而诱发骨质疏松。
造模方法:大鼠维甲酸(80 mg/kg/d)连续灌胃14~21 d,观察4周,取大鼠股骨测得骨密度、骨组织形态计量均显著降低,血清钙、磷、碱性磷酸盐、抗酒石酸碱性磷酸盐均显著增高。
③ 环磷酰胺诱导的继发性骨质疏松模型:
环磷酰胺是一种广谱抗肿瘤药,在骨代谢方面能够抑制骨形成,导致骨微结构退化,进而诱导骨质疏松症的发生发展。
造模方法:大鼠环磷酰胺(4.5 mg/kg/d)连续灌胃15 d即可诱导骨质疏松症。
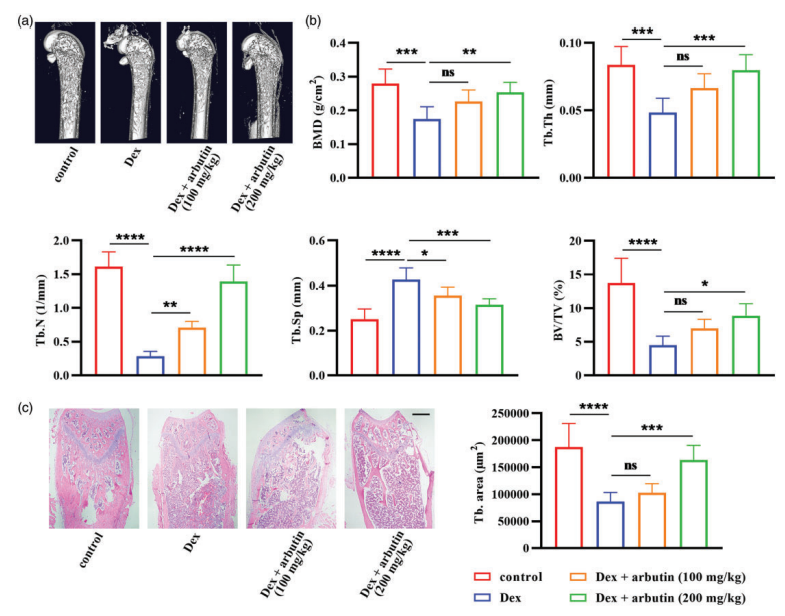
4、营养缺陷诱导骨质疏松模型[11]
营养是影响骨密度的众多因素之一,通过限制饮食中的钙、维生素D、蛋白质等的摄入可以成功建立营养缺乏型骨质疏松模型,该模型对研究因营养缺陷引起的OP有重要意义。但由于饲料配方复杂,且影响因素较多,普及推广困难。同时,因为单独应用营养法建模耗时长且成功率低,故常作为一种辅助方法。
造模方法:通过给大鼠饲喂低钙饮食造成骨吸收大于骨形成,从而得到低钙饮食诱导的OP模型或每天通过等渗泵皮下滴注去氨加压素(5 ng/h),同时每天给予70 mL/d (1.0 kcal/mL)的溶液和去离子水,连续3个月,使大鼠骨密度降低、骨小梁和皮质骨下降,得到低钠诱导的OP模型。
5、联合造模法
用去势法联合其他造模方法共同构建骨质疏松模型的方法亦是目前研究的热点,可以有效缩短造模时间。如去势联合糖皮质激素,去势联合低钙饮食,去势、低钙饮食、糖皮质激素三者联合等,且研究发现三联法较两联法对骨骼的影响更加明显。联合造模虽能加速造模,但干扰因素较多且复杂。
模型评价指标
骨质疏松模型是否复制成功,需要用客观的指标来评价,骨质疏松的动物模型和造模方法众多,但评价指标是一致的,主要有骨密度测定、骨组织形态计量学、生化检测分析、骨生物力学测试、体质量、性腺形态等,其中最主要的是骨量与骨组织病理学变化这两项指标。[12]
① 骨密度测定
动物模型的骨密度(BMD)是诊断骨质疏松、预测骨质疏松骨折风险及评估药物治疗效果的重要指标,骨密度指骨骼单位面积中矿物质的含量,骨质疏松的发生与骨密度下降有关。骨密度检测方法有多种,有双能X线吸收检测法(DXA)、显微CT检测法、定量超声检测法(QUS)等,其中DXA测定是目前公认的诊断骨质疏松症的金标准。DXA是依据X射线衰减原理,组织越致密,所含的电子就越多,光子衰减也越大,采用X线管球作为射线源,产生两种不同能量的射线,在低能量下,骨骼的衰减比软组织的衰减程度要大,而在高能量下,骨骼衰减和软组织的衰减是相当的,可以区分两种组织,探测骨密度丢失情况。
② 骨组织形态计量学
骨组织形态计量学(bone histomorphometry)主要研究对象是二维骨组织切片显微图像,以生理学和骨组织学为依据,通过分析并处理显微图像,获得骨组织结构的计量参数。骨计量学能对骨结构与骨质量相关指标进行定性、定量的客观评价,能从动态和静态两个方面反映骨新陈代谢过程,能准确地分析骨结构和骨脆性,以及破骨细胞和成骨细胞的数目,骨小梁的厚度和数目等。
③ 生化指标检测
骨质疏松生化指标检测主要有骨代谢激素和骨转换相关指标的检测:
激素与细胞因子:生长激素(GH)、雌激素(E1/E2/E3)、睾酮(T)、白细胞介素-1F(IL-1F)、白细胞介素-6(IL-6)、转化生长因子β、肿瘤坏死因子、胰岛素生长因子。
钙磷代谢调节相关:甲状旁腺素(PTH)、降钙素(CT)、维生素D3。
骨形成相关:骨特异性碱性磷酸酶(BALP)、骨钙素(OC/BGP)、I型前胶原C-端前肽/N-端前肽(PICP/PINP)、骨保护素(OPG)。
骨吸收相关:抗酒石酸酸性磷酸酶(TRACP)、I型胶原交联N-末端肽(NTX)、I型胶原交联C-末端肽(CTX)、吡啶啉(PYD)、脱氧吡啶啉(DPD)。
④ 骨生物力学指标
骨生物力学检测可反映骨质疏松骨组织结构和骨宏观力学效应如强度、硬度、韧性等情况,骨力学特性可间接反映骨矿盐分布、骨小梁空间结构等特性,可据此评价发生骨折的风险。常用的测量指标有骨干中段 3 点弯曲最大载荷、4点弯曲、抗扭转强度、轴向压缩实验、疲劳实验、椎体骨的抗压强度及破坏荷载等。
派思维新骨质疏松疾病模型案例研究
Case Study 1 : Ovariectomized rat model
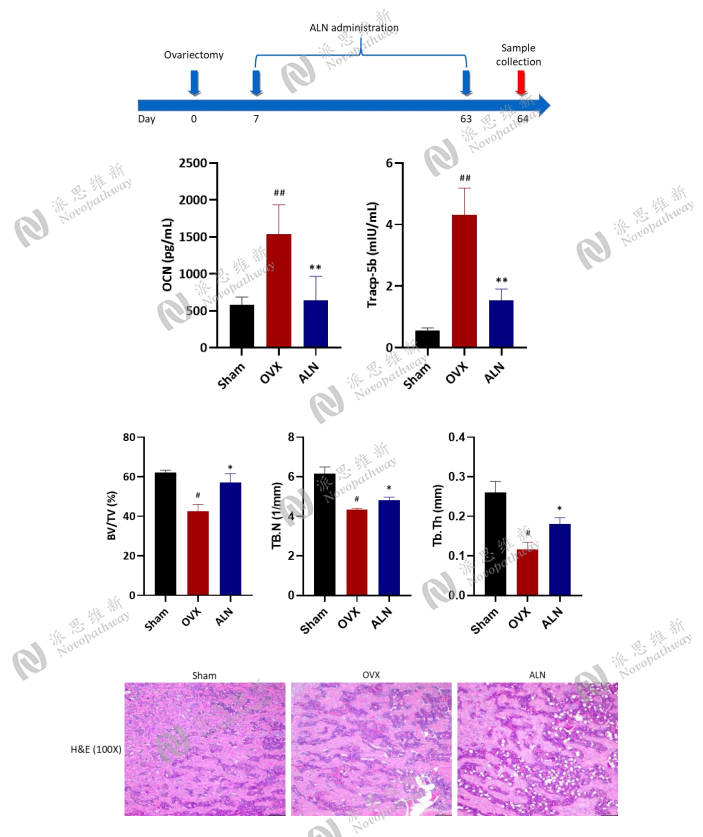
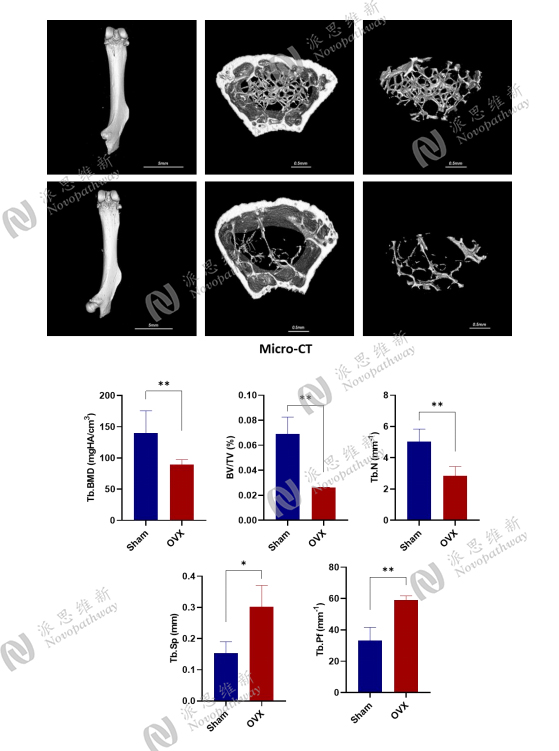
Case Study2 : Ovariectomized mice model
参考文献
[1] Rachner TD, Khosla S, Hofbauer LC. Osteoporosis: now and the future. Lancet. 2011 Apr 9;377(9773):1276-87. doi: 10.1016/S0140-6736(10)62349-5. Epub 2011 Mar 28. PMID: 21450337; PMCID: PMC3555696.
[2] Tao Z, Wang J, Wen K, Yao R, Da W, Zhou S, Meng Y, Qiu S, Yang K, Zhu Y, Tao L. Pyroptosis in Osteoblasts: A Novel Hypothesis Underlying the Pathogenesis of Osteoporosis. Front Endocrinol (Lausanne). 2021 Jan 8;11:548812. doi: 10.3389/fendo.2020.548812. PMID: 33488513; PMCID: PMC7821870.
[3] Huidrom S, Beg MA, Masood T. Post-menopausal Osteoporosis and Probiotics. Curr Drug Targets. 2021;22(7):816-822. doi: 10.2174/1389450121666201027124947. PMID: 33109043.
[4] Zhang Y, Li M, Liu Z, Fu Q. Arbutin ameliorates glucocorticoid-induced osteoporosis through activating autophagy in osteoblasts. Exp Biol Med (Maywood). 2021 Jul;246(14):1650-1659. doi: 10.1177/15353702211002136. Epub 2021 Mar 23. PMID: 33757338; PMCID: PMC8326434.
[5] Krishnan V, Bryant HU, Macdougald OA. Regulation of bone mass by Wnt signaling. J Clin Invest. 2006 May;116(5):1202-9. doi: 10.1172/JCI28551. PMID: 16670761; PMCID: PMC1451219.
[6] Zhang Z, Ren H, Shen G, Qiu T, Liang D, Yang Z, Yao Z, Tang J, Jiang X, Wei Q. Animal models for glucocorticoid-induced postmenopausal osteoporosis: An updated review. Biomed Pharmacother. 2016 Dec;84:438-446. doi: 10.1016/j.biopha.2016.09.045. Epub 2016 Sep 28. PMID: 27685786.
[7] Lin S, Huang J, Zheng L, Liu Y, Liu G, Li N, Wang K, Zou L, Wu T, Qin L, Cui L, Li G. Glucocorticoid-induced osteoporosis in growing rats. Calcif Tissue Int. 2014 Oct;95(4):362-73. doi: 10.1007/s00223-014-9899-7. Epub 2014 Aug 3. PMID: 25086673.
[8] Chen L, Shi X, Xie J, Weng SJ, Xie ZJ, Tang JH, Yan DY, Wang BZ, Fang KH, Hong CX, Wu ZY, Yang L. Apelin-13 induces mitophagy in bone marrow mesenchymal stem cells to suppress intracellular oxidative stress and ameliorate osteoporosis by activation of AMPK signaling pathway. Free Radic Biol Med. 2021 Feb 1;163:356-368. doi: 10.1016/j.freeradbiomed.2020.12.235. Epub 2020 Dec 30. PMID: 33385540.
[9] Oršolić N, Goluža E, Dikić D, Lisičić D, Sašilo K, Rođak E, Jeleč Z, Lazarus MV, Orct T. Role of flavonoids on oxidative stress and mineral contents in the retinoic acid-induced bone loss model of rat. Eur J Nutr. 2014 Aug;53(5):1217-27. doi: 10.1007/s00394-013-0622-7. Epub 2013 Nov 23. PMID: 24271527.
[10] 吕文亭.蒙药苏格木勒-7对维甲酸致骨质疏松小鼠的疗效及其作用机制的研究[D].内蒙古农业大学,2022.DOI:10.27229/d.cnki.gnmnu.2022.000029.
[11] Gao X, Ma W, Dong H, Yong Z, Su R. Establishing a rapid animal model of osteoporosis with ovariectomy plus low calcium diet in rats. Int J Clin Exp Pathol. 2014 Jul 15;7(8):5123-8. PMID: 25197386; PMCID: PMC4152076.
[12] 郭鱼波,马如风,王丽丽等.骨质疏松动物模型及其评价方法的研究进展[J].中国骨质疏松杂志,2015,21(09):1149-1154.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501
北京阳光诺和药物研究股份有限公司
办公地址:北京市昌平区双营西路79号院7号楼
总公司网址:http://www.sun-novo.com




