- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

世界阿尔兹海默病日丨远离“记忆橡皮擦”
阿尔兹海默症介绍

阿尔兹海默症(Alzheimer's disease)简称AD,俗称老年痴呆,是一种过程缓慢且不可逆的,以记忆功能和认知功能退化为特征的临床综合症,多发于老年期。临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征。AD的机制涉及多种假说,主要有β淀粉样蛋白(β-amyloid,Aβ)毒性、氧化应激、Tau蛋白异常磷酸化等,但发病机制尚未明确。
2012年《新英格兰医学杂志》上发表的一项对比研究结果显示,在发病的20年前,阿尔兹海默症的进程就已经开启。文中首次提议β淀粉样蛋白(β-amyloid,Aβ)毒性的有无,可能是治疗AD的主要原因,至今已被类文献引用超2300余次。
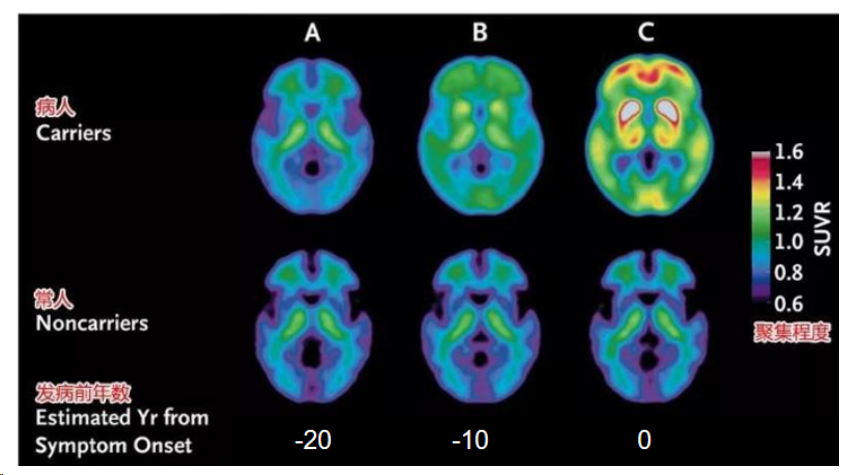
药物治疗与预后
胆碱酯酶抑制剂(AchEIs)是研究得最多的一类药物,也是到目前为止临床证实疗效比较好的药物。临床上使用的胆碱酯酶抑制剂主要有以下几种:
多奈哌齐(Donepezil,E2020),推荐起始剂量是5mg/d,1周后剂量可增加至10mg/d。推荐剂量为10mg/d。 重酒石酸卡巴拉汀(Rivastigmine),可给药2次/d,推荐剂量为6~12mg/d。 加兰他敏(Galantamine),给药2次/d,推荐剂量24mg/d。 石杉碱甲(Huperzine A),常用剂量是0.15~0.3mg/d。
主要用于治疗精神病性症状,如幻觉、妄想和冲动攻击行为等。阿尔茨海默患者由于脑器质性病变和躯体衰老,对抗精神病药的耐受性较差,治疗剂量通常只需1/3~1/2的成人剂量。
氟哌啶醇的起始剂量为1~2mg/d,推荐计量为2.5~5mg 奋乃静的起始剂量为2mg/d、推荐计量为2.5~5mg 舒必利的起始剂量为100~200mg/d 非典型抗精神病药利培酮起始剂量为05~1mg/d 奥氮平起始剂量为2.5~5mg/d 抗抑郁药:如5-羟色胺再摄取抑制剂(SSRIs):氟西汀20mg/d,帕罗西汀20mg/d,舍曲林50mg/d,氟伏沙明50mg/d,西酞普兰20mg/d。 抗焦虑药:主要是苯二氮类药,一般可分为长效制剂(半衰期约20h)如地西泮、氯硝西泮、氟西泮等;中效制剂(半衰期约12h)如阿普唑仑、氧西泮、劳拉西泮等;短效制剂(半衰期约3h)如三唑仑、咪达唑仑(也称速眠安)等。半寿期较短的药物多用于入睡困难,半寿期较长的药物适合焦虑、激惹和睡眠的维持治疗。
阿尔兹海默症因为作用机制尚未明确,所以目前没有有效的药物治疗方法,不能有效遏制阿尔茨海默病的进展,通常病程5~10年,有报道显示可更长。运动,社交,饮食调节,适当的脑力劳动,充足的睡眠与减压等是有效的预防方案。
构建AD体外/体内模型
肝脏是人体最大的实质性器官,被称为“人体的综合化工厂〞在人体中主要发挥着以下几点作用:
1、神经毒性损伤型造模试剂
1.1 Aβ
Aβ来自于其前体淀粉样蛋白前体蛋白(amyloid precursor protein,APP)第672-711残基裂解片段,长度在39-42个氨基酸的短肽。目前常采用20μM的Aβ1-42或Aβ25-35诱导细胞建立AD细胞模型。
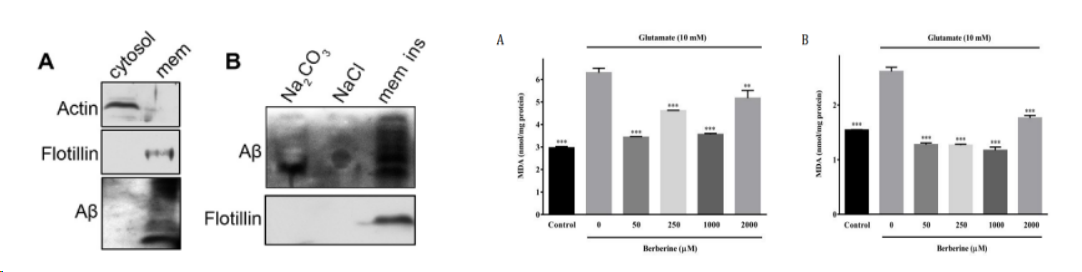
甲醛是毒性最强的有机化合物之一,可促进AD的主要病理特征形成,包括Aβ沉积、Tau蛋白过度磷酸化和神经元丢失,同时伴有细胞功能障碍甚至细胞凋亡。常采用0.35 mM的FA诱导N2a细胞,建立AD模型。
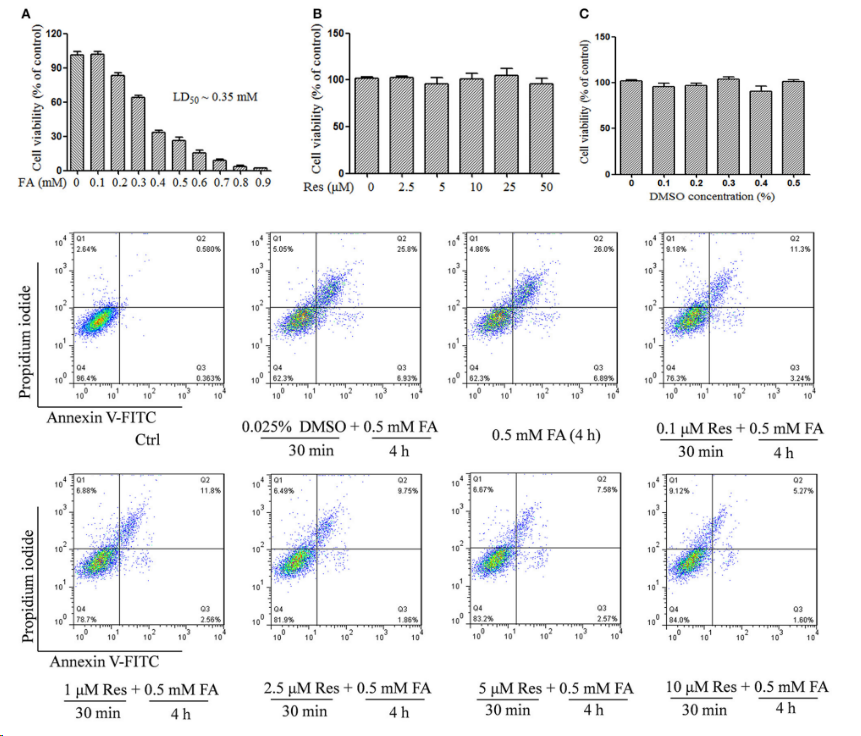
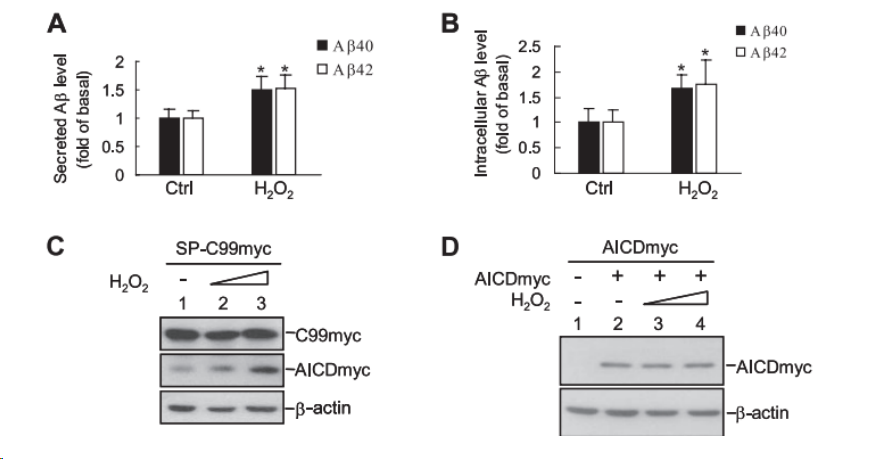
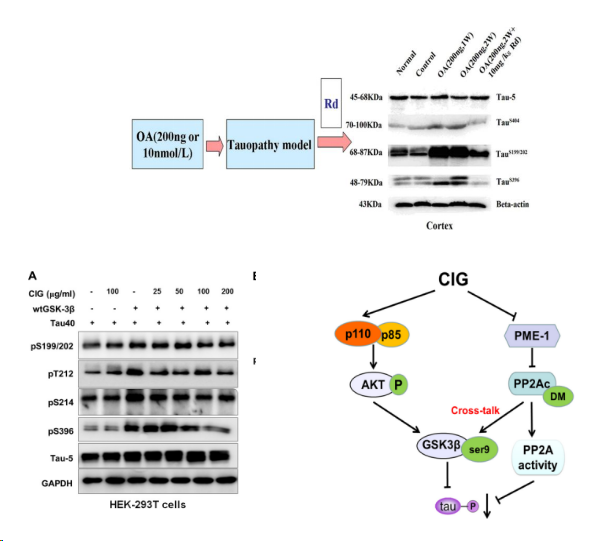
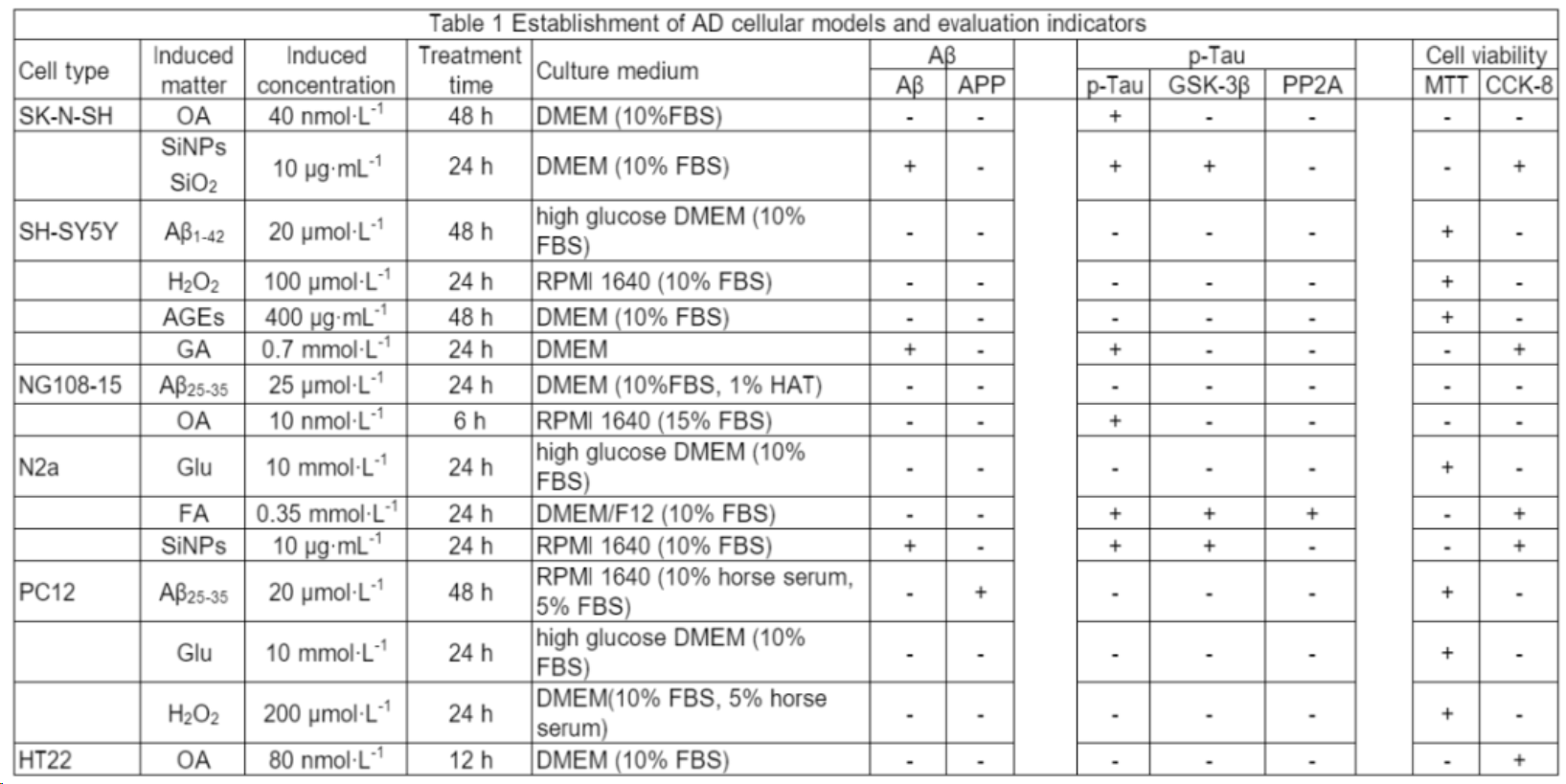
目前,常用于诱导人神经母细胞瘤细胞建立AD模型的造模试剂包括:Aβ、H2O2、AGEs、GA、OA、SiNPs等,其诱导时间大多为24h或48h。检测指标主要有细胞活力、凋亡率及相关凋亡蛋白表达、氧化应激相关指标、Tau蛋白磷酸化水平等,具体详情见Tab1。
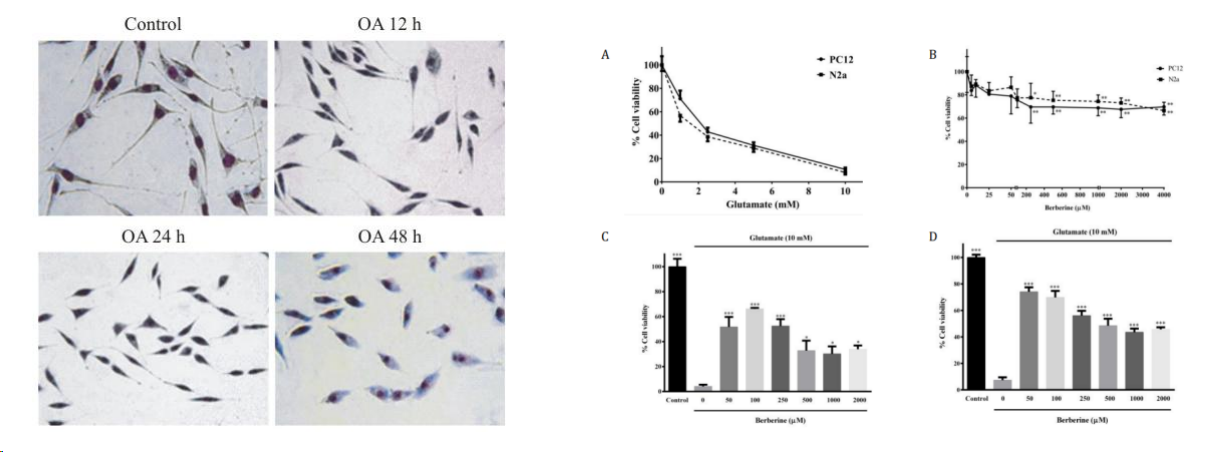
N2a细胞作为体外研究AD发病机制的常见细胞模型从A株白化鼠的自发性肿瘤而建立,呈神经元样。研究常采用Glu、FA、SiNPs等物质诱导N2a细胞建立AD模型。经造模试剂诱导后N2a细胞常出现Aβ沉积、Tau蛋白过度磷酸化、氧化损伤、细胞凋亡等AD样的病理学特征。具体造模方法见Tab1。
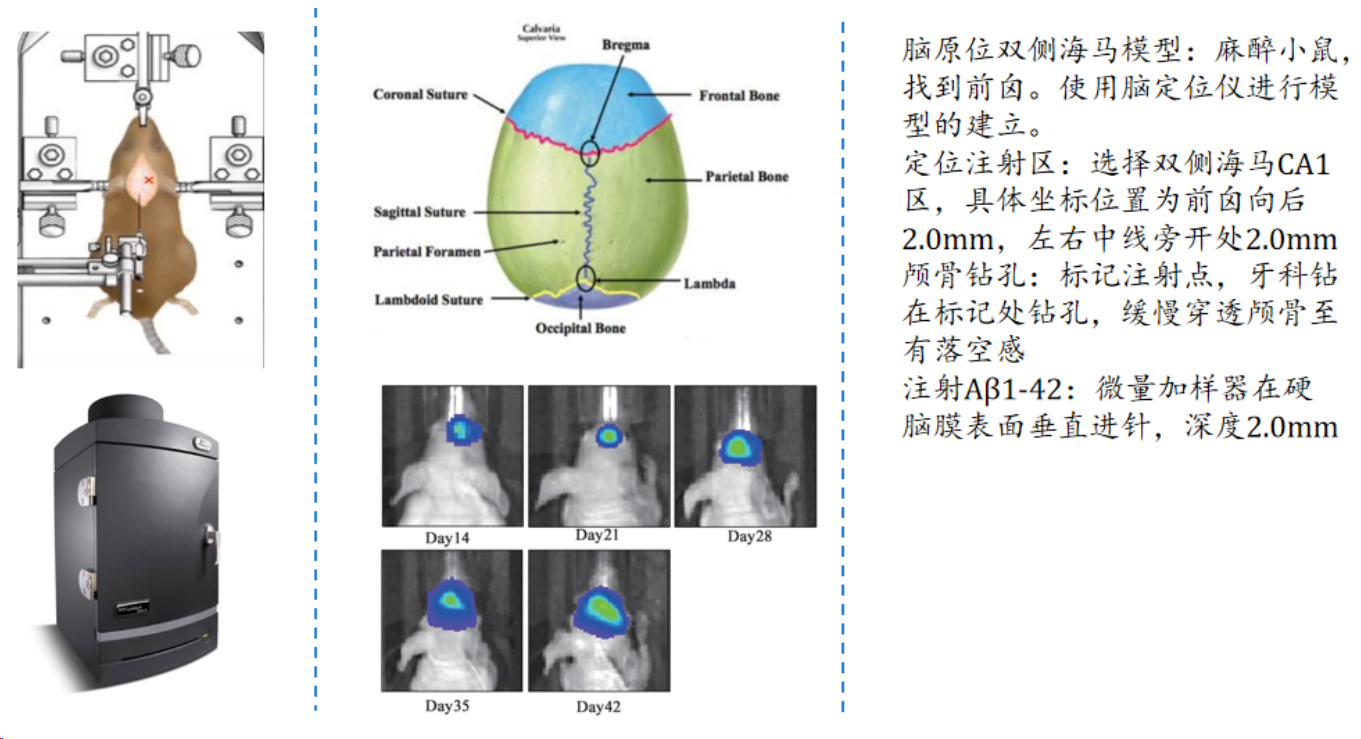
2.1 双侧海马立体定向注射Aβ1-42诱导阿尔茨海默症小鼠模型
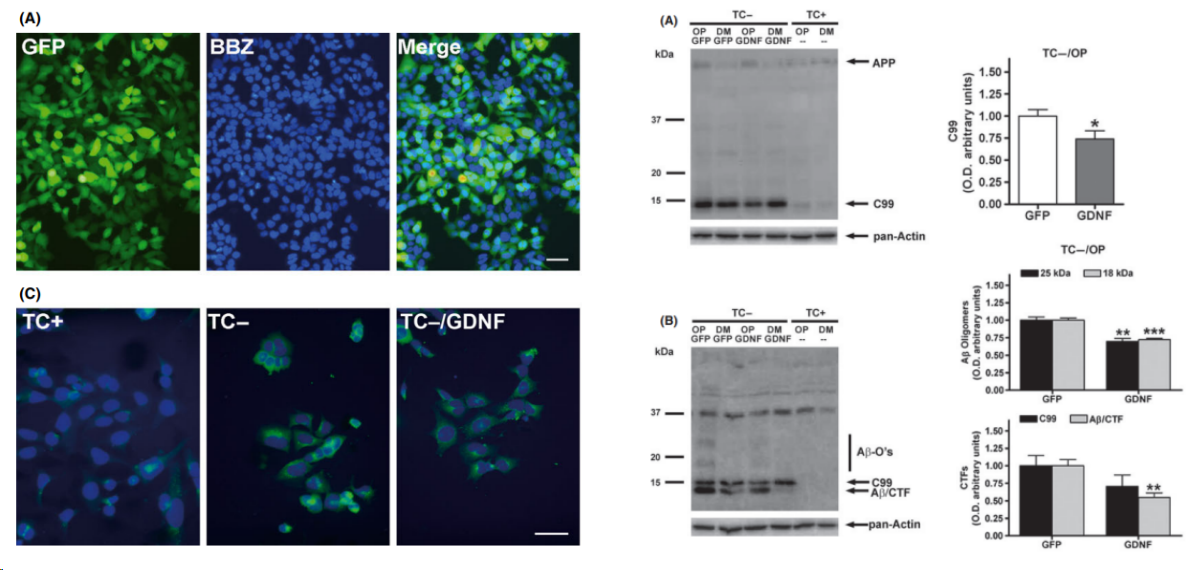
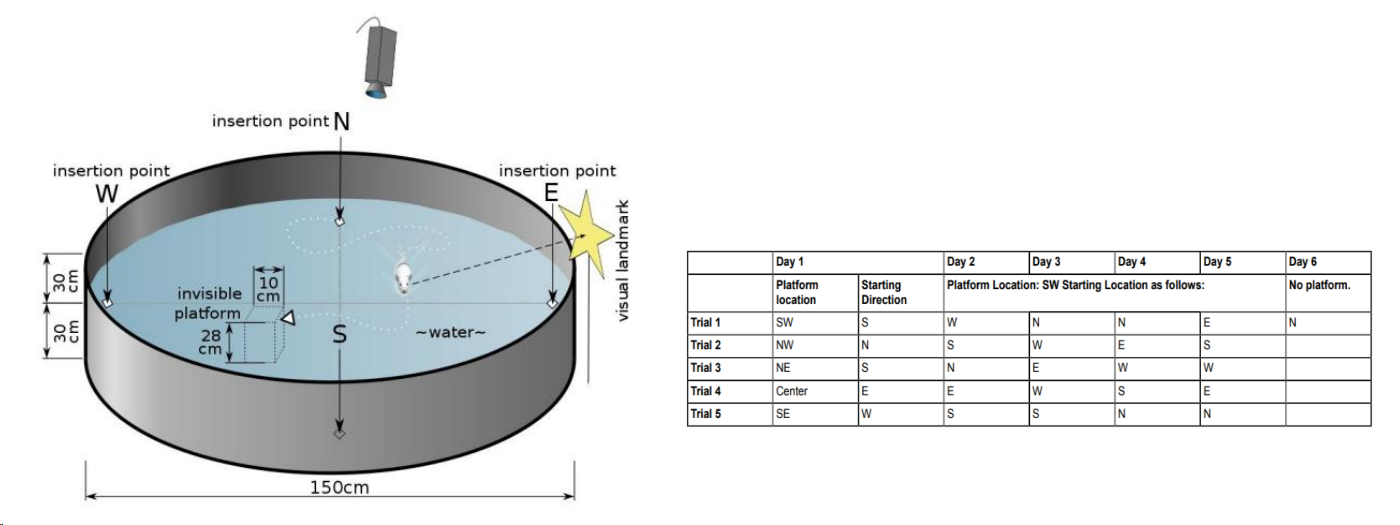
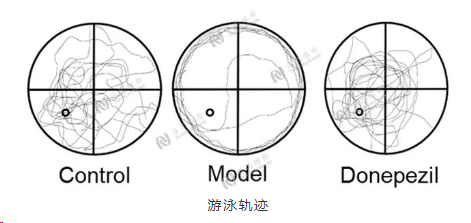
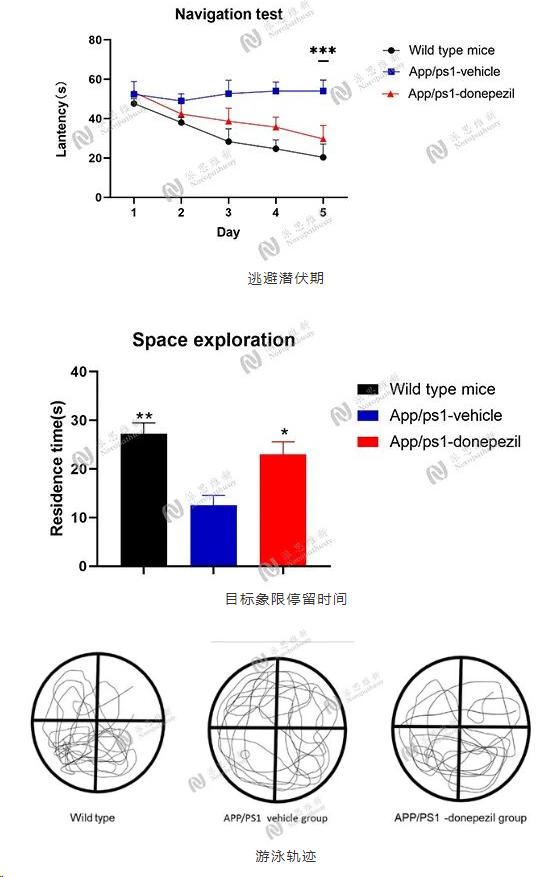
Morris 水迷宫验证模型
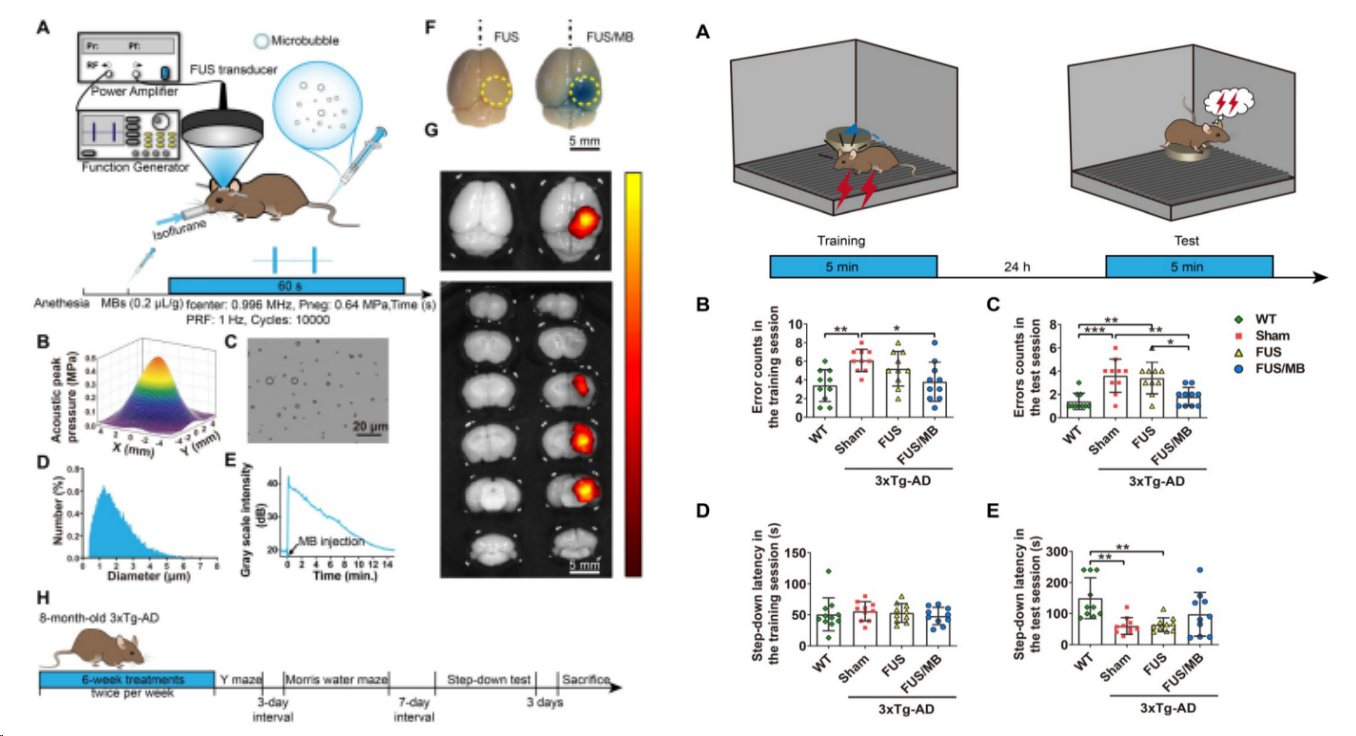
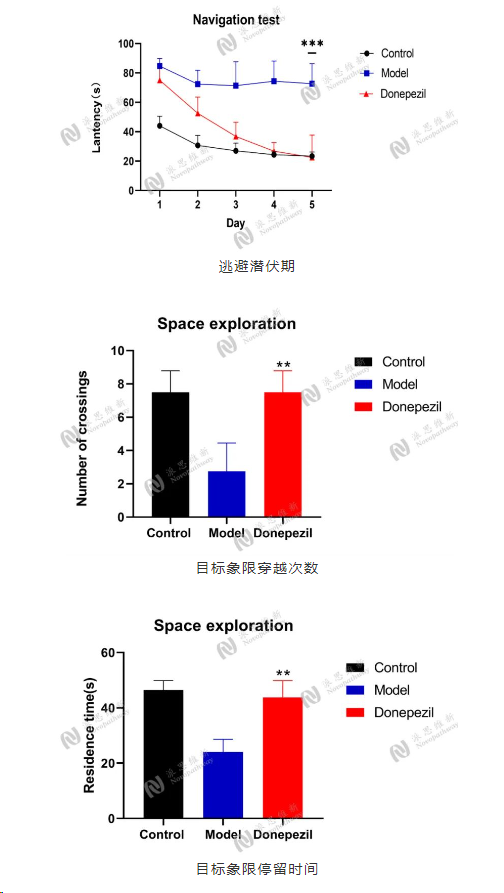
派思维新阿尔兹海默症模型案例分享介绍
Model:Scopolamine induced AD
Animal:C57BL/6 mice (male 8 weeks 18-20g)
Group:Control group, Model group, Donepezil group
Endpoint:Morris water maze test
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501
北京阳光诺和药物研究股份有限公司
办公地址:北京市昌平区双营西路79号院7号楼
总公司网址:http://www.sun-novo.com




