- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

世界银屑病日丨对抗顽疾,打赢皮肤保卫战!
银屑病疾病介绍
银屑病(Psoriasis)是由多基因遗传调控、T 淋巴细胞介导的慢性复发性炎症性皮肤病,以皮肤红色丘疹或斑块且上覆鳞屑为主要临床变现。以皮肤角质形成细胞角化不全、角化过度、异常增生、血管形成和炎性细胞浸润为主要的组织病理学特点。目前病因及发病机制尚未完全明确,治疗多集中于改善临床症状,控制复发。动物模型是目前研究疾病病因、发病机制和治疗方法的重要工具之一。
病因与机制:
银屑病是一种复杂的疾病,它的病因目前尚未完全明确,其发病和遗传、感染、免疫、精神等多种因素有密切联系,同时也受外界自然环境因素的影响。
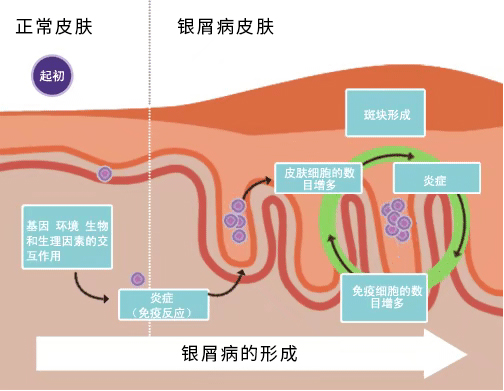
在研究自身免疫性疾病时最早发现并提出银屑病发病的“IL-23/Th17 通路”理论, 近年来人们对IL-23/Th17 通路有了更深入的认识和了解。一般认为在IL-23的刺激下,幼稚T细胞与激活的树突状细胞(DC)相互作用后分化为Th17,Th17细胞分泌IL-17(包括IL-17A和IL-17F),与角质形成细胞的IL-17R结合,角质形成细胞在IL-17的刺激下异常增殖和分化,产生趋化因子和血管生成因子,刺激炎症细胞的聚集,建立正反馈循环。趋化因子CCL20 是角质形成细胞衍生的重要核心成分,其功能是将 Th1、Th22和Th17细胞召集到活跃的受损皮肤中,Th1和Th22细胞通过产生炎症因子来放大核心反应,以及角质形成细胞衍生的血管生成因子和趋化因子,最终导致银屑病皮损的形成。
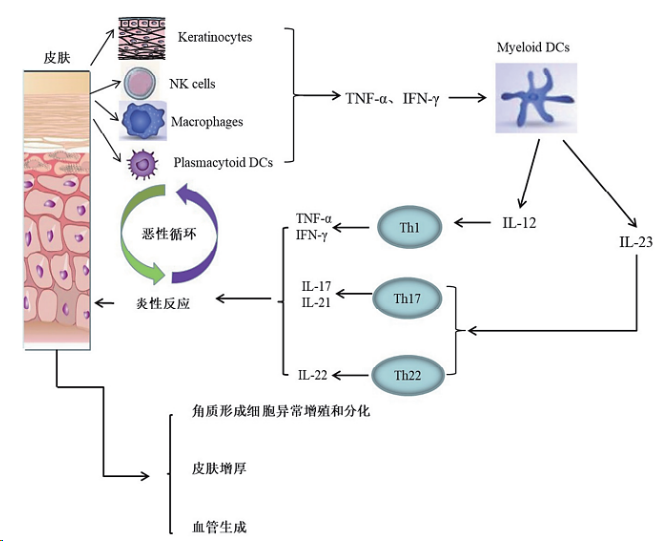
图示:IL-17在银屑病发病机制中的作用
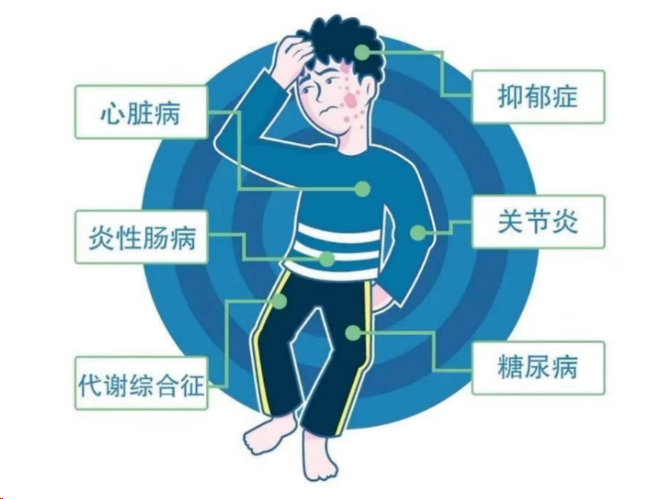
临床表现根据中国银屑病诊疗指南(2018简版)的银屑病分型体系,分为斑块状银屑病、点滴状银屑病、脓疱型银屑病、红皮病型银屑病和关节型银屑病,其中斑块型占90%以上。其中寻常型银屑病又分为点滴状银屑病、斑块状银屑病(85%以上)、反向性银屑病;脓疱型银屑病又分为掌趾脓疱型和泛发性脓疱型。临床皮疹表现为头部、四肢伸侧、躯干等部分的众多境界清楚、形状大小不一的浸润性红斑,表面覆有银白色鳞屑,常冬季加重、夏季减轻。与银屑病相关的并发症主要包括:关节炎、心血管疾病、代谢综合征、糖尿病、自身免疫性疾病等。
银屑病动物模型
银屑病的小鼠模型可分为自发性,基因工程 (转基因和基因敲除),异种移植和直接诱导。
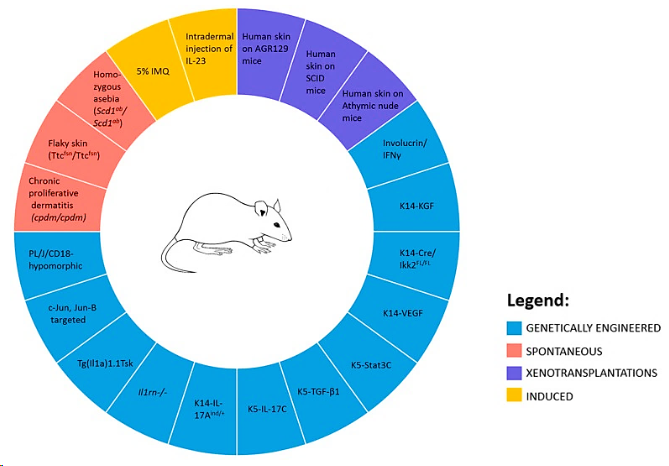
图示:用于研究银屑病的小鼠模型
该模型是通过IL-17/IL-23轴的免疫介导而产生,具有典型的银屑病病理改变,包括棘层肥厚、细胞角化不全、新生血管发生,CD4+T细胞、CD11c+DCs、pDCs浸润等,以及VEGF表达上调。但部分鼠皮损不典型,且缺乏完全的T细胞亚群的炎症浸润,以及皮疹持续时间较短。有研究发现,建模的效果与咪喹莫特的生产厂家有关。近来也有新的建模方式的报道,如建模时同时加用干扰素腹腔内注射,以及使用咪喹莫特诱导 K14-VEGF小鼠等,其模型的效果更佳,且皮损可以维持2周不退。
通常是BALB/c小鼠造模,小鼠背部或耳部皮肤均局部脱毛,每日局部涂搽5%咪喹莫特软膏62.5mg于背部或耳部脱毛皮肤,一般在第2~3d即可出现炎症反应,第6~7d日炎症反应可达高峰,小鼠皮损具有典型的银屑病表现和组织学特点,其中包括表皮的过度增生、角化不全伴角化过度、棘层增厚和炎症细胞浸润。而在小鼠皮损内及脾脏树突状细胞发现多种致炎细胞因子表达上调,如IL-1β、IL-6、TNF-α、IFN-α 等。
咪喹莫特诱导的银屑病模型由于建模简单,代表性较好,已被较多用于银屑病发病机制的研究和银屑病治疗药物的试验等。但该模型依然存在着局限性:①试验数据大部分来源于小鼠,限制了这些研究结果在人类银屑病中的适用性;②药物诱导的皮肤炎症在很大程度上具有相对非特异性,其临床表现及病理组织学表现与其他疾病存在重叠,例如特应性皮炎等;③药物诱导的动物模型是一种急性诱导模型,是一种急性炎症反应,因此不能完全再现银屑病的慢性炎症状态。
盐酸普萘洛尔可通过阻断角质形成细胞的β肾上腺素能受体,从而降低细胞内环磷酸腺苷(cAMP)水平,这一特有的药理作用使动物模型出现表皮角化过度、角化不全、棘层肥厚等类似人类银屑病的组织病理学表现.采用5%盐酸普萘洛尔乳膏涂抹于4~5周龄豚鼠的耳部、背部脱毛皮肤,连续涂抹3周或3周以上即可出现银屑病皮损及病理学改变。
该种模型操作简单,造模时间较短,且较好地模拟了人类银屑病组织病理学表皮的主要改变,但应用普萘洛尔造模局限于豚鼠,在其他品系小鼠中较少应用,且银屑病的其他病理特征不明显,该种模型有一定的局限性。
基因工程小鼠银屑病模型主要包括转基因小鼠模型和基因敲除小鼠模型,其中基因敲除小鼠可再分为完全基因敲除和部分基因敲除,通过完全或部分敲除小鼠的特定基因从而产生银屑病样皮损改变;而转基因小鼠模型是通过转基因技术使小鼠体内过表达某些特定基因,从而诱导出银屑病样皮损。这类模型大多通过控制表皮基底层的启动子,如角蛋白5(K5)、角蛋白14(K14)、角蛋白10(K10)或内披蛋白来达到过表达特定基因的目的,从而诱导银屑病样皮肤表现的形成。其中,K5-STAT3C转基因鼠模型、K5-TGFβ1 转基因鼠模型、K14-AREG转基因鼠模型是靶向作用于角质形成细胞的典型基因工程小鼠模型,其在启动子的作用下使特定基因在角质形成细胞内过度表达,致细胞因子和趋化因子表达上调,从而使角质形成细胞发生增殖并促发炎性瀑布反应,最终产生银屑病样改变;而KC-Tie2 转基因鼠模型、K14-VEGF 转基因鼠模型则是作用于血管内皮细胞,促进血管内皮细胞的迁移和增生,最终也使小鼠模型产生银屑病样皮损改变。
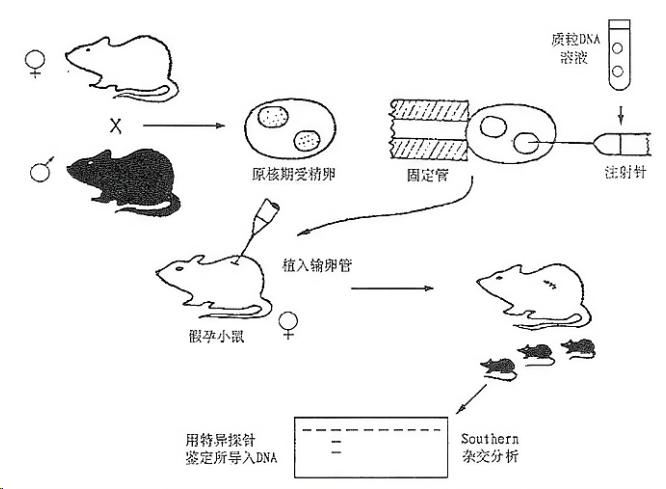
基因工程动物模型从分子及细胞的角度出发,通过处理特定单个基因继而使模型产生类银屑病样的皮肤病理表现,因而具有强烈的针对性,可以确定特定基因在银屑病病变过程中的作用,适合观察单个基因的表达功能及效应。但这类动物模型也有着它的局限性,比如其制作步骤复杂、耗费时间长、成本高。不能全面地模拟出人类银屑病的多种基因共同作用下的复杂过程。因此建立银屑病转基因动物模型还有进一步的探索空间。
自发性突变小鼠模型是指在自然情况下,未经任何人工处理,出现银屑病样皮损表现的小鼠模型,是第一个被发现在某些遗传背景下及等位基因突变后所导致的银屑病小鼠模型,其自发性突变小鼠模型的突出例子有Asebia小鼠、鳞片状皮肤小鼠(Fsn小鼠)、慢性增殖性皮炎小鼠等。这类自发性突变小鼠模型全出现银屑病组织病理学表现,如棘层肥厚、真皮内巨噬细胞及肥大细胞浸润、血管分布增多,然而在其组织病理学切片中,T细胞及中性粒细胞少见。同时,对银屑病的常规治疗药物效果欠佳,如环孢素、维甲酸等。随着银屑病动物模型建模方式的逐渐进步,这类自发性突变鼠模型的应用已逐渐退出历史舞台,逐渐成为其他银屑病动物模型的遗传背景。
自2006 年开始,随着各种细胞因子皮内注射动物模型的出现,有研究者逐渐发现向小鼠皮肤注射细胞因子会引发急性银屑病样皮损。目前,向小鼠皮肤注射IL-23、IL-12、IL-36、IL-22、IL-17C等一系列细胞因子并联合抑瘤素M(Oncostatin-M)和IL-33已被应用于诱导银屑病样皮肤炎症。在各种细胞因子注射小鼠模型中,注射IL-23是最为常见的建模方式。由于该模型所诱导的银屑病样皮损为急性炎症反应,一旦停止注射,皮损表现即自行逐渐消退,也是该模型存在的局限性。
该类模型是目前最接近银屑病的结合了其完整遗传、表型和免疫、致病过程的动物模型,这种方法的基本原理是将人类银屑病患者的非病变或病变皮肤组织移植到严重免疫缺陷小鼠上,尽量使模型达到“人源化”标准。目前该类模型主要受体小鼠为无胸腺裸鼠、严重联合免疫缺陷鼠(SCID小鼠)及AGR129鼠。然而,因其需要获得大量银屑病患者未经治疗过的病变或非病变皮肤组织和外周血,且需要快速收集组织和移植,以防止移植物缺血和排斥反应,再加上受体小鼠需要的饲养条件高、价格昂贵,导致该模型并未得到广泛应用。
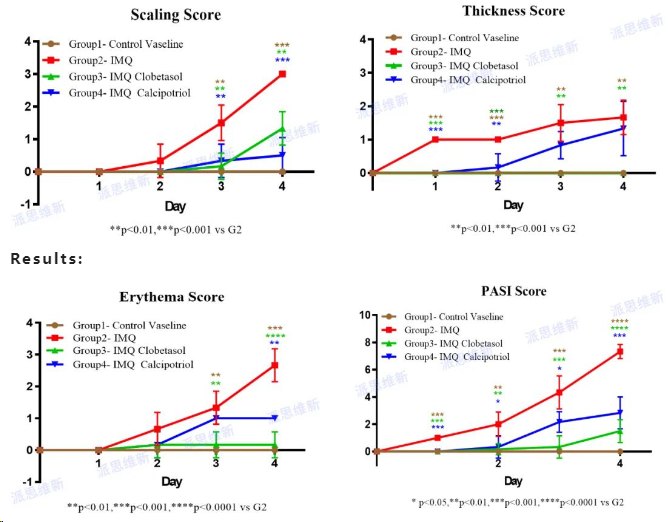
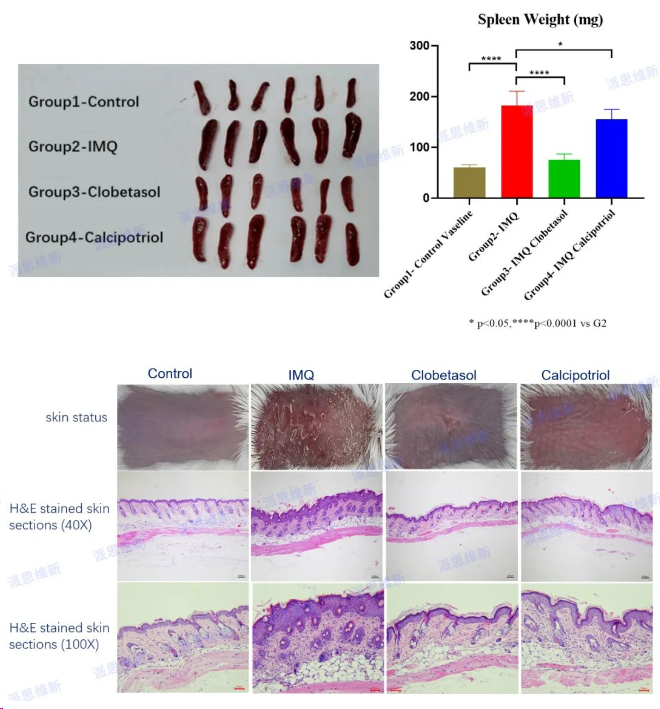
派思维新银屑病模型案例分享
参考文献
1. Leslie van der Fits , Sabine Mourits, Jane S A Voerman. Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the IL-23/IL-17 axis. J Immunol, 2009 May 1;182(9):5836-45. doi: 10.4049/jimmunol.0802999.
2. Murali Badanthadka, Lidwin D’Souza and Fathima Salwa. Strain specific response of mice to IMQ-induced psoriasis. J Basic Clin Physiol Pharmacol 2021; 1-10.
3. 杨梅,唐彩红,桂雨晴,等. 咪喹莫特诱导银屑病模型小鼠T细胞免疫功能改变与性别的关系[J]. 中国药理学通报,2022,38(4):589-597. DOI:10.12360/CPB202108021.
4. 张同梅, 王刚. 银屑病动物模型研究进展[J]. 实用皮肤病学杂志, 2018, 11(5):5.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501
北京阳光诺和药物研究股份有限公司
办公地址:北京市昌平区双营西路79号院7号楼
总公司网址:http://www.sun-novo.com




