- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

世界帕金森病日 | PD的发病机制和动物模型应用研究
帕金森疾病介绍
Parkinson's disease(PD)是神经退行性疾病的一种,伴有认知神经以及自主神经功能障碍,其主要病理学特征是中脑黑质中多巴胺(DA)能神经元的变性和死亡,残存神经元中路易小体(LB)的形成和α-突触核蛋白的聚集也是帕金森病的典型特征之一。

中脑内的黑质(substantia nigra)[1]呈半月形,位于中脑被盖和大脑脚底之间,在新鲜标本呈黑色而得名,黑质致密部(SNpc)主要为多巴胺能神经元,是脑内合成多巴胺的主要核团,发生病变时,多巴胺合成减少,是引起PD的主要病因。

图1:Parkinson's disease(PD)
PD动物模型的制备方法
MPTP诱导小鼠帕金森模型
脂溶性的神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6 tetra-hydropyridine,MPTP)是目前发现的第一个能复现帕金森症状的化学药物。穿越血脑屏障(blood-brain barrier)后,MPTP被神经胶质细胞中的单胺氧化酶B(MAOB)代谢为中间体MPDP+,进一步氧化后,最终形成神经毒素甲基-苯基四氢吡啶鎓盐(MPP +)[2]。
该MPP+会错误地被多巴胺转运体(dopamine transporter, DAT)吸收到胞内,抑制线粒体呼吸链复合体I的活性,阻断电子转移链,减少ATP的生成并促进活性氧(reactive oxygen species)的产生,最终造成多巴胺能神经元的损伤,导致类似PD的症状。

图2:MPTP的代谢途径和胞内路径
MPTP造模方式
MPTP诱导的PD模型尤其是小鼠模型的造模周期短(1-2周),技术简捷(仅需腹腔注射),即可完成对中脑黑质多巴胺能神经元的杀伤。且MPTP的毒性存在种属差异,小鼠较为敏感,因此常用MPTP诱导小鼠模型。常用案例的具体实施步骤是1)选用6-8周龄,体重25-30g的雄性C57BL/6小鼠,适应性饲养3-7天;2)腹腔注射Fresh MPTP溶液。根据造模形式与试剂用量,周期可细分为以下4 种:(1)小剂量MPTP模式(10~20mg/kg),一次腹腔注射;(2)急性帕金森病模型,20mg/kg的MPTP间断腹腔注射4次,每次间隔2h,导致细胞快速坏死;(3)亚急性帕金森模型, 20~30mg/kg的MPTP注射,1次/天,连续5天,导致缓慢的细胞凋亡;(4)慢性帕金森病模型,剂量为4mg/kg,1次/天,连续20天。3)注射30分钟后,可观察到例类似于僵“或”颤“等类似帕金森的症状。4)注射约3小时后,未代谢的MPTP随排泄物释放。故建模后小鼠需隔离饲养,约1-2周后对动物的病理和行为学表现进行评估检测,确认造模是否成功。
采用百草枯二氯化物(PQ: paraquat dichloride)作为阳性对比,通过PIHC(石蜡包埋病理成像染色技术)对比验证MPTP的建模稳定性。

图3:Pathological assessment of SNpc and striatum in PQ- or MPTP-treated mice.
以对照组Control为例,阳性参照组(PD百草枯)与MPTP造模组的中脑黑质多巴胺的数量显著减少。
6-OHDA诱导帕金森模型
6-羟多巴胺(6-hydroxydopamine,6-OHDA)是多巴胺的羟基化衍生物,能够通过多巴胺或去甲肾上腺素转运体进入神经元,但是不能穿透血脑屏障BBB,使用6-OHDA进行造模时需要借用脑立体定位注射技术将6-OHDA注入到三种注射靶点即:黑质致密部(substantia nigra pars compacta,SNpc)、纹状体(striatum)或者位于二者之间的前脑内侧束(MFB)。
由Ungerstedt和Arbuthnott在1970年共同创立的单侧注射旋转模型是目前应用最为广范的帕金森大鼠模型。该模型的优点是能选择或特异性的捣毁黑质多巴胺能神经元,因此可有效用于研究治疗PD药物疗效。缺点是不能很好地模拟出PD常见的如静止性震颤等临床症状。也不能表现出路易小体( Lewy bodies)的聚集现象。
动物:6-8周龄的C57/BL小鼠,雌雄不限,体重20-25g左右。
饲养:与MPTP诱导的模型相同,动物订购之后需要至少适应性饲养1周后再进行造模手术。
脑定位注射:在33G的Hamilton注射器或玻璃电极中预先吸入1μL左右浓度为3μg/mL的6-OHDA溶液。小鼠麻醉后固定在脑立体定位仪上。调节立体定位仪,找到注射位点所在的坐标,注射位点可以是黑质,也可以是前脑内侧束或纹状体。注射结束后,注射针应该继续停留在注射位点5分钟左右以使药物能够充分扩散。提起注射针,将动物的头皮缝合并消毒。
术后护理:脑定位注射完成后将动物放在加热板或灯光下照射保持体温。待动物苏醒后放回笼中。术后3天内每天腹腔注射一次抗生素。大约3-4周后可以进行行为学检测。
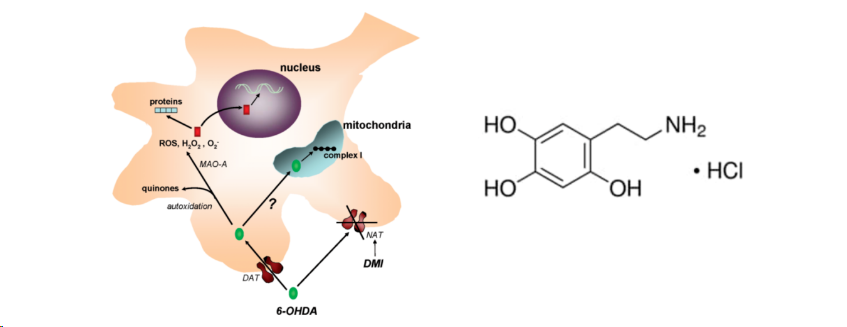
图4:6-OHDA介导的神经毒性作用机制
大鼠单侧6-OHDA模型
动物:6-8周龄的wistar大鼠,雌雄不限,体重200-240g左右。
饲养:与MPTP诱导的模型相同,动物订购之后需要至少适应性饲养1周后再进行造模手术。
脑定位注射:1)将麻醉后大鼠固定于脑立体定向仪上;2)剪开头皮后将前囟(bregma)和后囟(lambda)点暴露出来;3)调节立体定位仪,找到注射位点所在的坐标;4)用颅骨钻钻孔,以保证微量注射器进针时不碰到孔壁。吸取6-OHDA缓慢插入注射位点,以0.5ul/min的速度将6-OHDA注射到目标脑区,注射剂量为4μl;5)将一定量的6-OHDA注射至一侧的黑质或内侧前脑束建立“单侧”损伤的帕金森病模型鼠,在注射后24h出现多巴胺神经元的变性,2~3天后出现纹状体内多巴胺含量减少,成功的模型发现其纹状体内多巴胺含量减少了80%~90%。6-OHDA单侧损毁模型是目前在研究中使用最多的动物模型之一,它可以在同1只动物的损伤侧与非损伤侧进行相互对比;同时药物诱发的旋转行为检测是评价PD干预疗效的稳定性指标。

鱼藤酮(Rotenone)诱导帕金森模型
鱼滕酮是一种天然有机杀虫剂,具有亲脂性,可透过血脑屏障,具有细胞毒性,并且是一种线粒体复合物Ⅰ的高亲和力的特异性抑制剂,通过促进线粒体活性氧的产生来诱导细胞凋亡,也可用于诱导自发性帕金森病(PD)。
动物:选8-10周龄的雄性Lewis大鼠,体重为300~350g,饲养:与MPTP诱导的模型相同,动物订购之后需要至少适应性饲养1周后再进行造模手术。
造模方式:大鼠用水合氯醛(350~400mg/kg)或戊巴比妥钠(50~60mg/kg)经腹腔注射麻醉后,剃除背部毛发,局部皮肤消毒,将渗透微泵埋入背部皮下。每日(2~3mg/kg)的剂量灌注鱼滕酮(V/V Ratio1:1;DMSO/PEG),连续5周。可选择性引起黑质-纹 体DA系统变性,在黑质细胞内有类似Lewy小体的α-syntrclein阳性包涵形成。行为学表征面运动减少,有时伴强直、震颤。[6]
模型特点:与人类PD类似,该模型同时复制出PD多巴胺能神经细胞中的包涵体和氧化应激损伤,因此鱼藤酮模型概括了PD发病中的多数重要机制。使用此模型进行神经保护性药物实验比用其他急性的PD模型效果更好。缺点是制备过程费时、费力,双侧损伤的动物很难存活。

图6:持续输注鱼藤酮导致黑质纹状体多巴胺日益减少
基于α-突触核蛋白的模型
除了多巴胺神经元丢失之外,帕金森病的另一种典型的神经病理标志是残存的神经元胞质内出现一种嗜酸性的包涵体,即路易小体(Lewy bodies, LBs)。其特征是包括带有辐射细丝的中央致密核(脑干),异常出现在中脑特定区域黑质致密部神经细胞的细胞核周围的路易小体、神经元突起中的路易轴突(Lewy neurites)等,已经确定为帕金森病的主要病理学特征之一。路易小体的主要组成成分是一种叫做α-突触核蛋白(α-synuclein, α-Syn)的突触前蛋白。α-突触核蛋白的聚集和路易小体的形成与多巴胺神经元的死亡有着密切的联系。
相比于使用神经毒素杀伤多巴胺神经元的帕金森模型,基于α-突触核蛋白的帕金森病模型由于在时程上能够较好地模拟帕金森病发生、发展的全过程,这有利于发现和识别新的治疗靶点。在诸多基于α-突触核蛋白的帕金森模型中,近年来被最广泛使用的模型可以归纳为2种:预制纤维(pre-performed fibrils, PFFs)和AAV病毒颗粒模型。
预制纤维模式首先在体外由重组的α-突触核蛋白单体生成。使用脑立体定位注射的方式将PFFs注射进脑内,在大约12周后将会诱发内源α-突触核蛋白的聚集、磷酸化和泛素化反应。
另一种有效的方式是使用重组腺相关病毒(recombinant adeno-associated virus, rAAV)外源过表达野生型或点突变型(如A53T)α-突触核蛋白。目前的研究显示,使用常用的CMV或者hSyn启动子均可以提供高水平的基因表达效率。另外,使用一些转录后调控元件,如土拨鼠肝炎病毒转录后调节序列(WPRE)或者poly(A)尾巴同样可以显著提高转基因的效率。[7]
动物:6-8周龄的C57/BL小鼠或PD相关的转基因鼠,雌雄不限,体重20-25g左右。
饲养:动物订购之后需要至少适应性饲养1周后再进行脑定位注射。
脑定位注射:使用10μL,33G的Hamilton注射器预先吸入2.5μL左右α-突触核蛋白PFFs,其中α-突触核蛋白纤维的含量约为5μg。动物开颅和调平操作与6-OHDA注射一致。α-突触核蛋白通常被单侧注射在纹状体(AP+0.2 mm; ML±2.00mm;DV-2.60mm)。注射针缓慢插入注射位点,以0.1 μL/min的速度将PFFs注射到目标脑区。注射结束后,注射针应该继续停留在注射位点5分钟左右以使纤维充分扩散。最后提起注射针,将动物的头皮缝合并消毒。
如果是病毒注射,则需构建AAV2/1-A53T(人α-突触核蛋白A53T点突变型)-EGFP-WPRE病毒载体,用注射器或玻璃电极吸取1.5μL,滴度为2-3×1012v.g./mL病毒,并以0.1μL/min的速度单侧注射在黑质(AP-3.1mm; ML-1.4mm; DV-4.4mm)。
术后护理:脑定位注射完成后将动物放在加热板或灯光下照射保持体温。待动物苏醒后放回笼中。术后3天内每天腹腔注射一次抗生素。大约90天后动物会逐渐表现出帕金森表型。

图7:纹状体注射的坐标示意图
派思维新PD模型案例分享
PD模型的检测与评估
酪氨酸羟化酶(tyrosine Hydroxylase,TH):是介导多巴胺生物合成的关键限速步骤。因此,运动评价和TH的表达及活性检测是帕金森病的重要指标。
转棒实验:使用小鼠转棒仪检测小鼠的运动协调能力。 将小鼠置于旋转杆上,转速调整为30r/min,每次同时测定5只小鼠,每个隔室中1只。记录小鼠从转棒开始转动至掉落转棒所经历的时间,测定时间为1min,每次中间休息1min,连续5次,记录1min内掉落次数。一般超过7转/min即为成功的帕金森病模型,否则为不成功模型。 爬杆实验:评价小鼠运动协调能力的经典方法。
旷场实验:即自发活动,是检测MPT损伤后运动能力的常用指标。
取各组小鼠脑组织,经固定液固定、石蜡包埋、切片后,进行尼氏小体染色。观察各组动物脑组织中尼氏小体的数量。
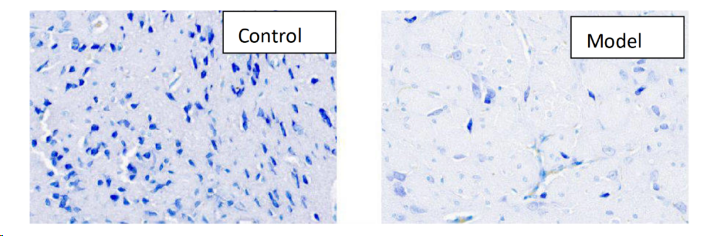
图8:尼氏小体染色
3. 免疫组化检测脑黑质TH表达

图9:IHC评估中脑黑质TH表达
参考文献
[1]Rizek, P., Kumar, N., & Jog, M. S. (2016). An update on the diagnosis and treatment of Parkinson disease.CMAJ : Canadian Medical Association journal, 188(16), 1157–1165. https://doi.org/10.1503/cmaj.151179
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501
北京阳光诺和药物研究股份有限公司
办公地址:北京市昌平区双营西路79号院7号楼
总公司网址:http://www.sun-novo.com




