- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

派思维新 | 肿瘤动物模型助力三阴性乳腺癌临床前药效研究
01.研究背景
最新数据显示,乳腺癌已成为女性恶性肿瘤发病率第1位的疾病。乳腺癌的分型多种多样,其中三阴性乳腺癌(TNBC)因预后极差被称为“乳腺癌之王”,晚期TNBC的5年生存率仅为11%。TNBC患者雌激素受体(ER)、孕激素受体(PR)和原癌基因(HER-2)均为阴性,且具有特殊的生物学行为和临床病理特征,缺乏有效的治疗靶点,侵袭性强,具有较高的复发风险和死亡率[1-4]。目前,手术仍然是治疗乳腺癌的首选治疗方案,切除乳腺肿瘤可以阻止肿瘤进展或扩散,但术后需要进行化疗等措施,改善远期预后。通过长期随访发现,TNBC患者即使经过规范化治疗,仍存在较高复发转移风险,应寻找新的治疗靶点,以提高治疗针对性,以便更好的改善患者预后。
TNBC临床相关靶点主要为BRCA1/2、VEGF、免疫指标MSI/PD-L1/TMB等[5-6]。目前与BRCA1/2相关的主要药物有PARP抑制剂奥拉帕利,VEGF靶点相关药物有贝伐珠单抗,MSI/PD-L1免疫相关药物有帕博利珠单抗等[7]。BRCA1/2突变与PARP抑制剂的使用相关,BRCA的主要抗肿瘤机制是阻断PARP参与DNA损伤修复,加重细胞DNA损伤。此外,PARP抑制剂可通过协同致死效应杀死BRCA突变的肿瘤细胞。VEGF主要涉及RTKs信号通路,是TNBC靶向治疗的重要靶点之一。贝伐单抗作为一种新型抗VEGF药物,在患者治疗及安全性方面均具有良好的效果[8]。PD-L1一般表达在肿瘤细胞和抗原提呈细胞等表面,PD-1是活化T细胞的抑制性受体,肿瘤细胞表面的PD-L1和活化T细胞的 PD-1 结合后,会抑制T细胞,导致T细胞无法识别肿瘤细胞,从而实现免疫逃逸,阻断PD-1/PD-L1信号通路主要是恢复T细胞免疫功能起到抗肿瘤作用。因此,基于免疫抑制靶点PD-1/ PD-L1 抑制剂能够调节机体的抗肿瘤免疫反应,进而发挥抗肿瘤作用。此外,有研究证明,SNRNP200是糖酵解TNBC的关键驱动因素,可以促进异常细胞代谢,特别是在乳酸和谷胱甘肽途径中,并赋予对免疫检查点阻断的抵抗力[9]。这些发现促使SNRNP200成为一个有潜力的治疗靶点,糖酵解TNBC中的乳酸脱氢酶(LDH)抑制剂,已经取得一定的显著进展。派思维新拥有众多TNBC动物模型,可以用于评价各药物在体内的治疗效果。
02.派思维新乳腺癌模型案例分享
2.1 4T1皮下模型
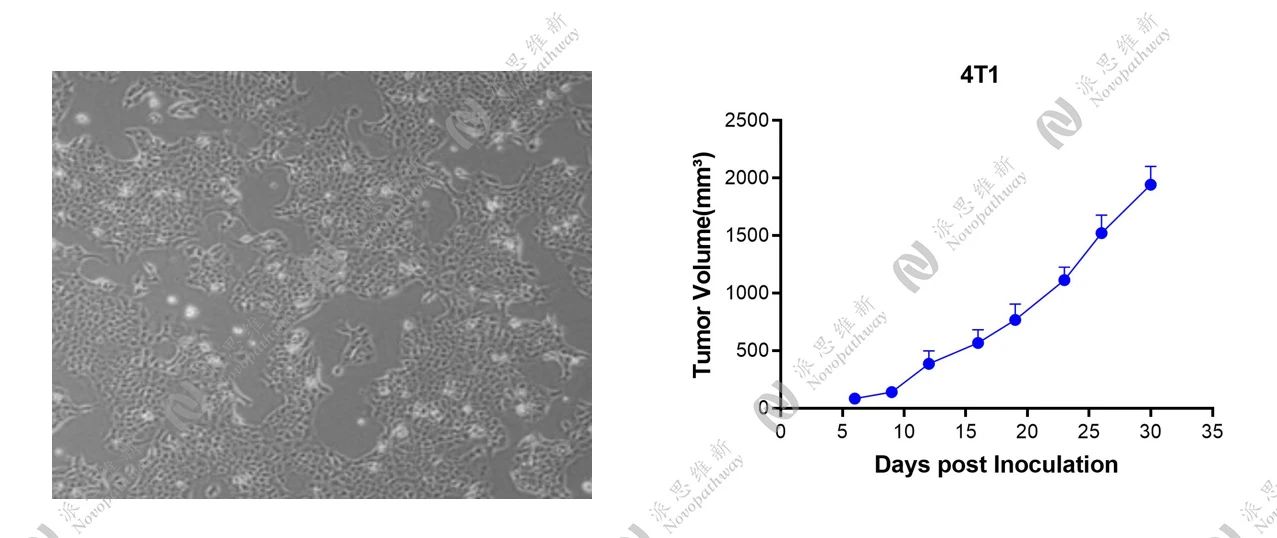
细胞照片及生长曲线
在携带SNRNP200靶点的4T1肿瘤小鼠皮下模型中,我们设立Positive Control组,统计肿瘤体积变化、小鼠体重变化等结果,结果显示,Positive Control具有一定的抗肿瘤作用。
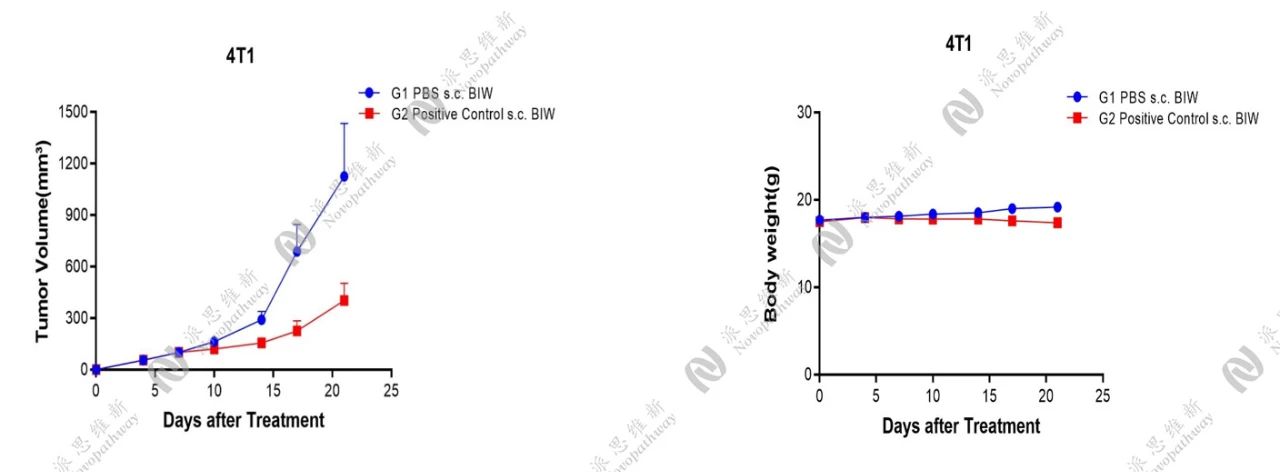
肿瘤体积及小鼠体重变化情况
此外,在4T1小鼠皮下模型中,我们还设立IgG2α组、Positive Control组以及Positive Control+anti-PD-1联合治疗组,统计肿瘤体积变化、小鼠体重变化、流式细胞术分析等结果,结果显示,Positive Control及Positive Cotrol+anti-PD-1联合治疗均具有一定的抗肿瘤作用。其中,联合治疗产生了更加明显的免疫反应,CD8+T细胞比例显著增加。此外,Positive Control及联合治疗均降低了CD25+Foxp3+调节性T细胞比例。
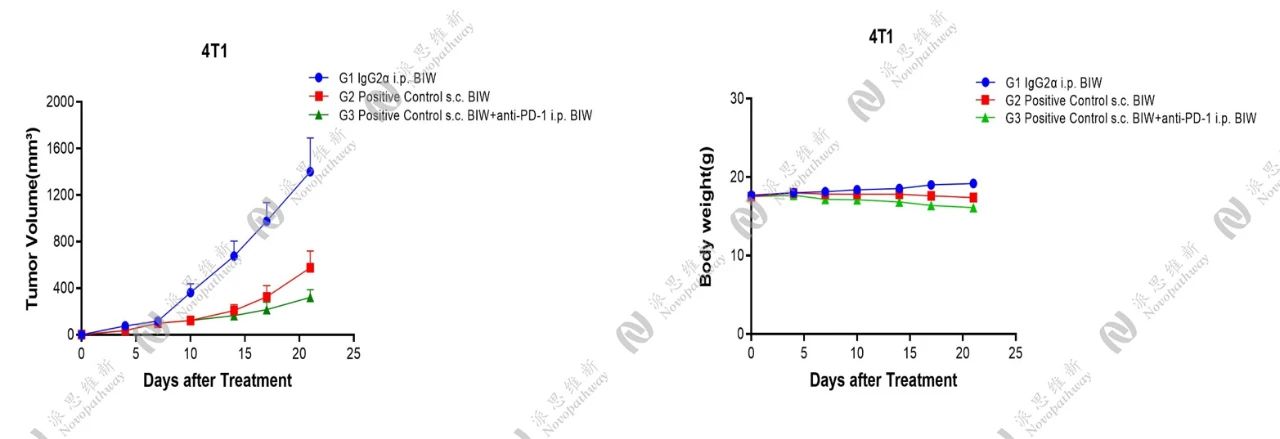
肿瘤体积及小鼠体重变化情况
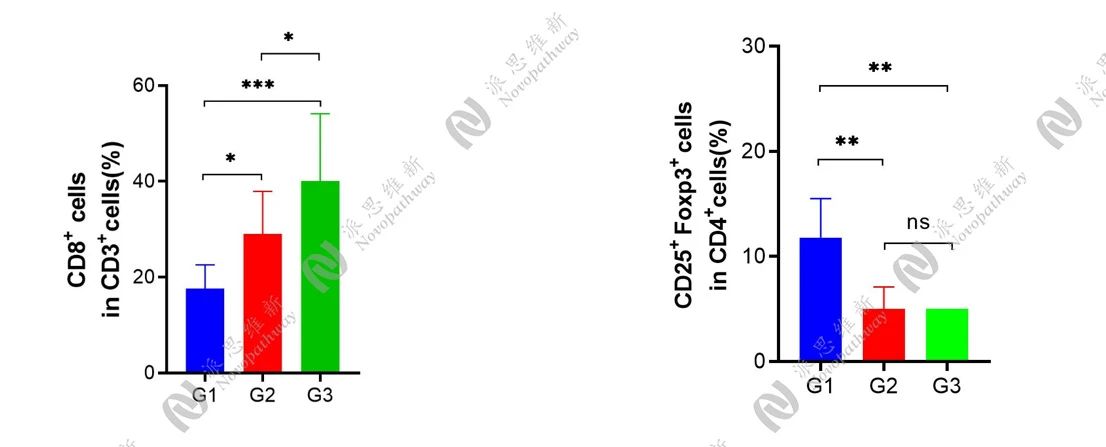
肿瘤组织流式细胞术分析结果
2.2 MDA-MB-231-luc原位模型
在BALB/c nude小鼠的右侧乳腺进行乳腺原位接种,接种后第3天进行一次活体成像拍摄,确认是否成功建立乳腺原位模型。接种后第8天根据原位的生物发光值进行随机分组给药。结果显示,G2组与联合治疗组均具有一定的抑瘤作用。
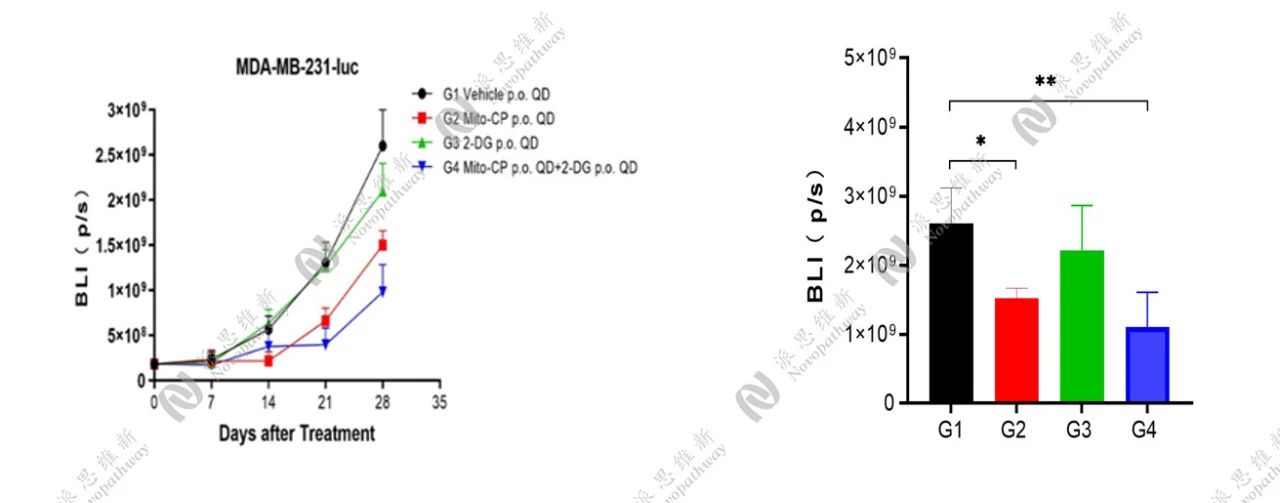
原位肿瘤生物发光值(p/s)
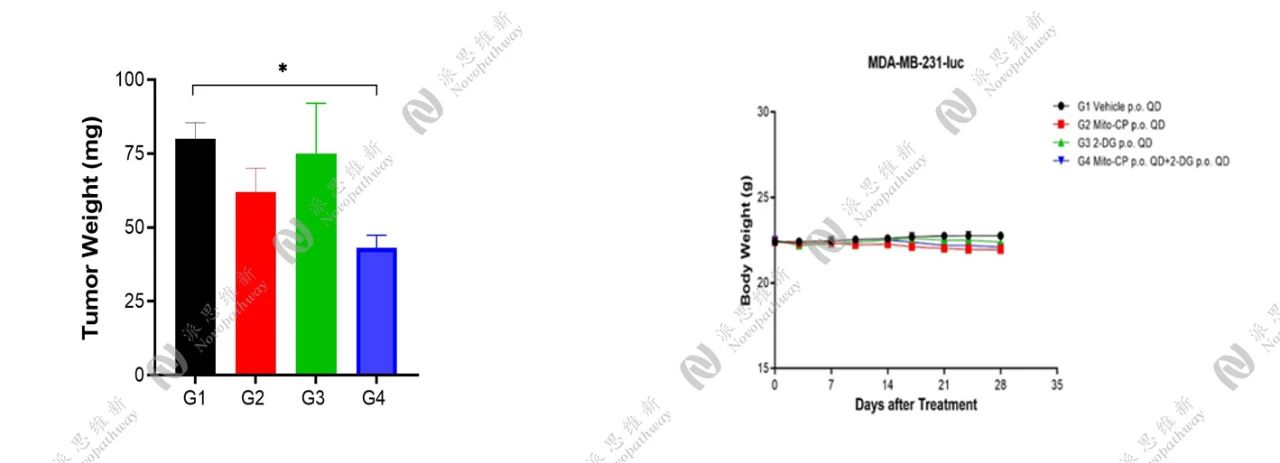
原位肿瘤重量及小鼠体重变化情况
2.3 4T1-luc转移模型
BALB/c小鼠上经尾静脉注射4T1-luc细胞,建立转移模型。转移模型建立3天后,进行随机分组给药。统计转移情况、小鼠体重、生存期等。结果显示,给药组可抑制肿瘤细胞向其他脏器转移,且对小鼠体重及生存期没有显著影响。

小鼠体重及生存期变化情况
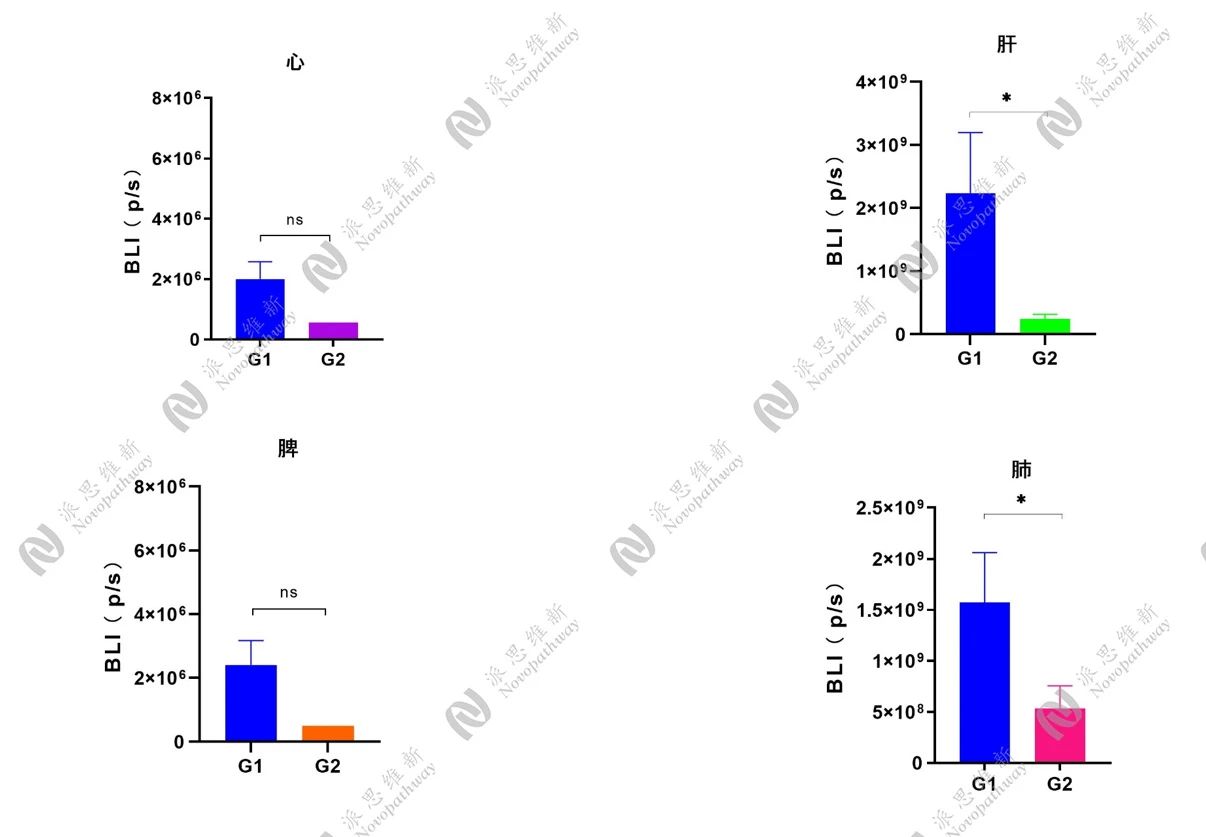
心、肝、脾、肺生物发光值(p/s)
2.4 MDA-MB-231人乳腺癌人源化模型
流式检测了PBMC接种后2W,3W,4W抗凝全血,验证了huCD45的百分比,并在MDA-MB-231人源化模型上进行了药效研究。
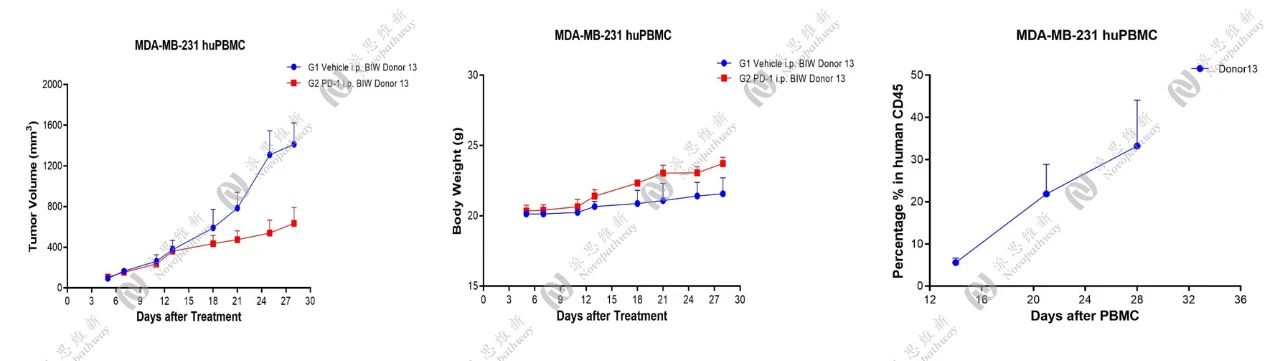
MDA-MB-231人乳腺癌人源化模型药效研究
2.5 MDA-MB-468人乳腺癌人源化模型
流式检测了PBMC接种后2W,3W,4W抗凝全血,验证了huCD45的百分比,并在MDA-MB-468人源化模型上进行了药效研究。
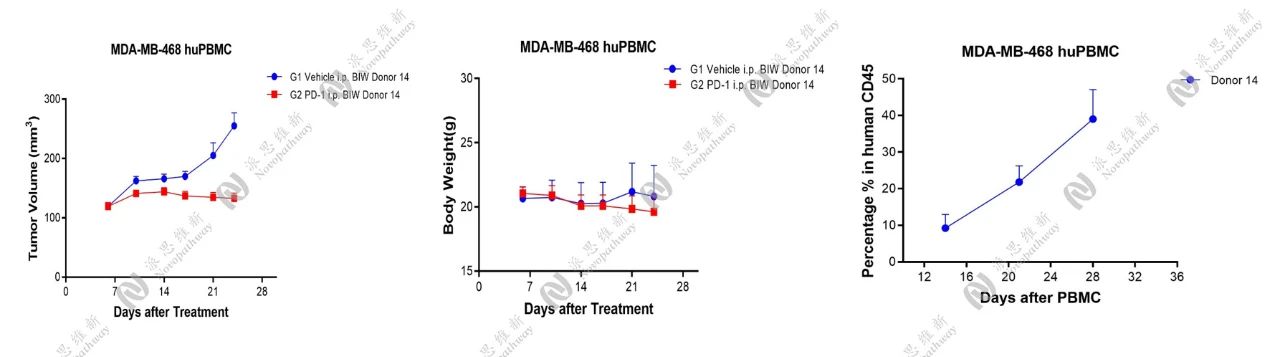
MDA-MB-468人乳腺癌人源化模型药效研究
派思维新利用多种动物模型,为TNBC的临床前药效研究提供精准的模型数据。目前,派思维新已经为多家药企和科研单位提供稳定可靠的模型数据,推动了TNBC临床前药效研究。
参考文献
[1] Navrátil J, Fabián P, Palácová M, et al. Triple negativní karcinom prsu[J]. Klin Onkol, 2015, 28(6): 405-415.
[2] Foulkes W D, Smith I E, Reis-Filho J S. Triple-negative breast cancer[J]. New England journal of medicine, 2010, 363(20): 1938-1948.
[3] Bianchini G, De Angelis C, Licata L, et al. Treatment landscape of triple-negative breast cancer—expanded options, evolving needs[J]. Nature reviews Clinical oncology, 2022, 19(2): 91-113.
[4]Leon-Ferre R A, Goetz M P. Advances in systemic therapies for triple negative breast cancer[J]. Bmj, 2023, 381.
[5] Litton J K, Beck J T, Jones J M, et al. Neoadjuvant talazoparib in patients with germline BRCA1/2 mutation-positive, early-stage triple-negative breast cancer: results of a phase II study[J]. The Oncologist, 2023, 28(10): 845-855.
[6] Kumar S, Chatterjee M, Ghosh P, et al. Targeting PD-1/PD-L1 in cancer immunotherapy: an effective strategy for treatment of triple-negative breast cancer (TNBC) patients[J]. Genes & Diseases, 2023, 10(4): 1318-1350.
[7]韦雪妮,杨忠慧,黄吉,等.三阴性乳腺癌相关靶点研究现状[J].医学信息, 2024,37(17): 188-192.
[8] Mohamed R F, Bakri H A M, Eid S. Does bevacizumab carry a hope for metastatic triple-negative breast cancer in the era of immunotherapy?[J]. Anti-Cancer Drugs, 2022, 33(1): e604-e609.
[9] Yang W, Hong L, Guo L, et al. Targeting SNRNP200-induced splicing dysregulation offers an immunotherapy opportunity for glycolytic triple-negative breast cancer[J]. Cell Discovery, 2024, 10(1): 96.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




