- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

派思维新 | 动物模型构建助力炎症肠病药物的研发
01.前言
1.1什么是炎症性肠病
炎症性肠病(inflammatory bowel disease,IBD)是一种以消化道炎症和黏膜破坏为特征的自身免疫性疾病,主要分为克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)两种类型[4-6]。免疫失衡、肠道屏障通透性的改变、微生物群的状态以及饮食与生活方式等环境因素的变化都对该病的发生和发展有很大影响。

CD和UC表型区别
02.IBD治疗现状
2.1IBD临床表现
2.2IBD发病机制
IBD目前病因及发病机制尚不明确,随着研究的不断深入,人们发现在IBD的发病过程中,细胞因子的作用和免疫调节的紊乱是极其重要的因素。
2.3研究进展
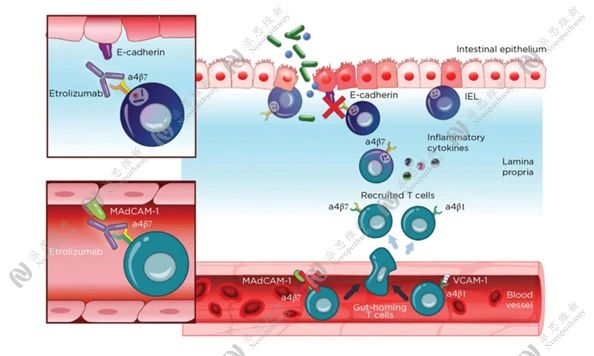
免疫调节药物在炎症性肠病中的作用机制[13]
目前处于临床研究状态的国产IBD新药可大致分为4个种类:生物制剂、小分子、干细胞和中药。如下表:
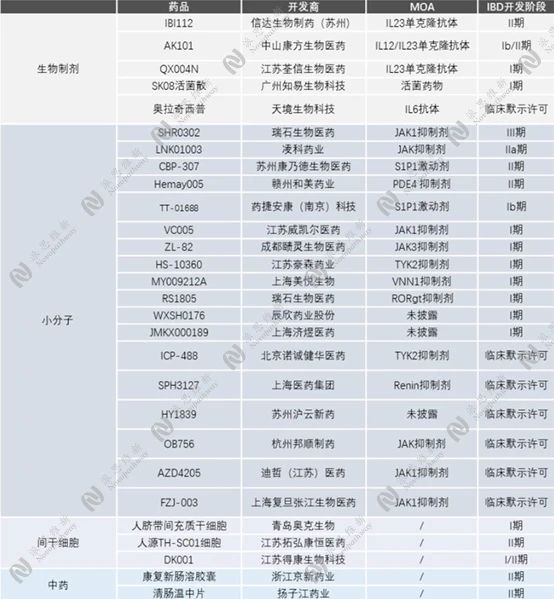
IBD国产在研新药[14]
目前关于IBD确切发病机制尚不明确,研究指出,该疾病发展可能与遗传、免疫失调、环境和肠道菌群等因素有高度相关。临床上尚无对IBD的治疗效果理想的药物,寻找治疗IBD的新方法,提高IBD的治疗效果,一直是近年来的研究热点。
因此,建立IBD动物模型对于阐明IBD的病因和发病机制,从而达到有效防治的目的,具有重要的现实意义。
03.化学诱导的结肠炎动物模型
目前已经开发出动物模型,主要可以分为以下几类:
恶唑酮(OXZ)或三硝基苯磺酸(TNBS)诱导的IBD模型
造模机制:OXZ和TNBS均具有半抗原性质,可诱导T细胞介导的免疫反应。细胞介导的2型(Th2)免疫反应,白细胞介素-4(IL-4)和白细胞介素-5(IL-5)的产生明显增加,并伴有体质量减轻、腹泻、溃疡和大肠上皮细胞减少。
模型特点:TNBS诱导以IL-12驱动的TH1反应为主,形成横向进展的炎症,导致透壁结肠炎,TNBS可诱导克罗恩氏病(CD)的临床前模型。恶唑酮诱导的免疫反应是Th2介导的,会导致弥漫性结肠炎症。用于研究皮肤中的迟发型超敏反应,也用于评估靶向Th2介导机制的药物。
造模方法:小鼠背部脱毛,涂抹1%的TNBS溶液150μL预致敏,七日后麻醉后小鼠,将导管插入直肠100px,将100μL的1.5%TNBS缓慢注射进入小鼠直肠内,倒置1min,以防止结肠内液体流出,造模后通过DAI评分判定造模情况。
葡聚糖硫酸钠(DSS)诱导的IBD模型
造模机制:DSS诱导小鼠肠炎模型是目前应用最广泛的化学诱导小鼠IBD模型。通过在饮用水中溶解DSS诱导急性溃疡性肠炎或慢性结肠炎,破坏小鼠肠道上皮细胞,非特异性免疫细胞释放细胞因子,最终导致粘膜屏障完整性被破坏。虽然该模型最早的改变是结肠隐窝逐渐破裂,但在后期恢复阶段,巨噬细胞和分化的CD4+T细胞在肠黏膜固有层基础部分的伤口愈合区变得更加突出。动物表现出明显的体重减轻、稀便、便血等症状,其临床症状和病理特征与人类溃疡性结肠炎非常相似。
模型特点:DSS所致的UC模型的特点取决于以下几个因素,具体包括DDS 剂量(通常为 1%~5%)、持续时间(急性或慢性)、动物种属(C3H/HeJ 和BALB/ c小鼠更易受感染)、动物的性别(雄性小鼠更易受感染),以及动物的微生物环境(在无菌(GF)级或无特定病原体(SPF)级环境下受感染不同。据报道,DSS引起的UC模型应用于化合物、基因/细胞治疗和微生物干预的药效学研究并获得较好的效果。
造模方法:DSS造模方法简单,通常采用2.0%~5.0%DSS水溶液供造模组小鼠自由饮用7天,对照组小鼠则饮用正常高压灭菌水以造急性结肠炎。给造模组动物饮用2.0%~5.0%DSS溶液7天,第8天将DSS溶液更换为正常饮用水,持续14天后,重复前面的步骤2-4次以造慢性结肠炎。
醋酸诱导的IBD模型
造模机制:直肠内注射稀醋酸可以对黏膜上皮造成化学损伤,导致上皮坏死、血管损伤而使血管通透性增加,从而诱发IBD表型。
模型特点:该模型导致直肠溃疡和黏膜损伤有时可延伸到肠黏膜固有层,在小鼠模型中在几天内开始愈合,但在大鼠模型中需要几周。醋酸所致结肠炎的优点是成本低,给药方便。
造模方法:大鼠麻醉后,将导管插入直肠6-200px,缓慢注入4%醋酸,保持接触30s,然后用5ml生理盐水冲洗2次,倒置30秒,以防止结肠内液体流出。
基因修饰IBD动物模型
近年来随着转基因和基因敲除技术的发展,可以通过基因工程进行造模的优点是靶点针对性强,可以通过特定的靶点(如免疫相关和肠道黏膜屏障相关)设计相应的IBD动物模型。
IL-7转基因(Tg)小鼠模型
IL-2 KO 小鼠模型
Gαi2 KO小鼠模型
T cell receptor α(TCRα)基因敲除(KO)小鼠模型
Wiskott-Aldrich综合症蛋白(WASP)KO 小鼠模型
multi-drug resistance gene-1a,(Mdr1a)KO 小鼠模型
小结
不同的肠炎模型都有优缺点,在使用不同的模型评估不同药物的体内疗效时,需关注以下方面:
①临床上一般是在疾病确诊后进行药物治疗。在动物模型中预防给药并不能代表预期药物的临床使用,虽然预防给药能研究药物的作用机制,但它们缺乏与肠炎相关的复杂性;
②与急性模型比较,在长期慢性模型中进行药效学试验,可能更能反映与人类疾病相关的复杂的免疫表现;
③依赖于微生物组存在的模型与临床肠炎相关性较好,虽然很可能表现出与临床肠炎病理相似的特征,但在不同的实验室可能缺乏可重复性;
④动物模型与影响药物治疗方法的相关性。阐明靶点作用机制,以及试验终点与临床终点的相关性,在动物模型的选择中至关重要。
04.派思维新IBD肠炎模型案例研究分享
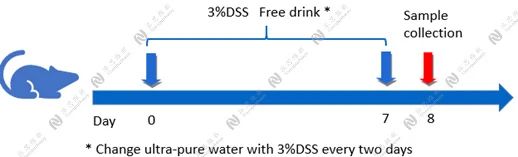
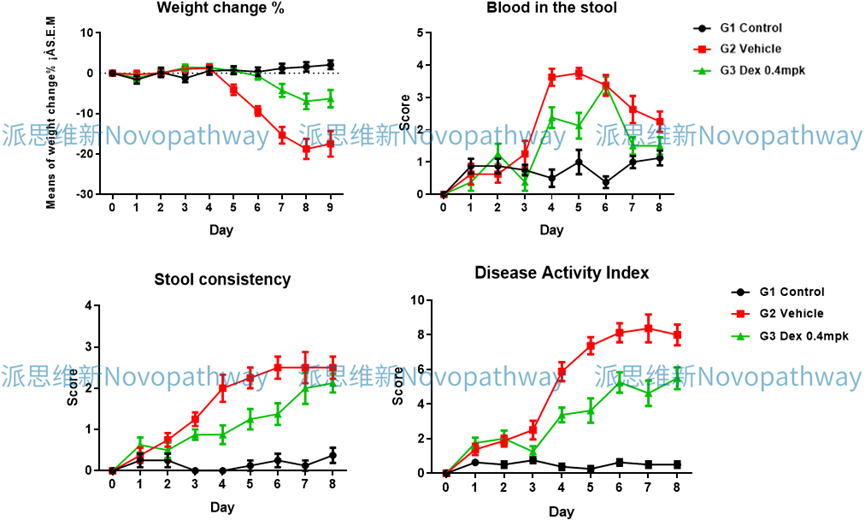
Case Study: DSS induced IBD model
Aim:To validate the effect of Dex on DSS induced IBD model in C57BL/6 mice.
Animal:C57BL/6 mice, female, 6 - 8 weeks,18-20g.
Reagent:DSS , Dex
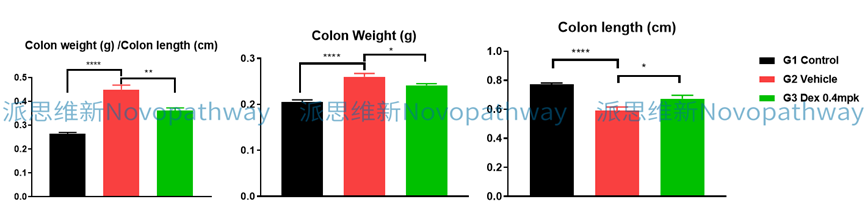
Aim:To validate the effect of CsA on DSS induced IBD model in C57BL/6 mice.
Animal:C57BL/6 mice, female, 6 - 8 weeks,18-20g.
Reagent:DSS , CsA
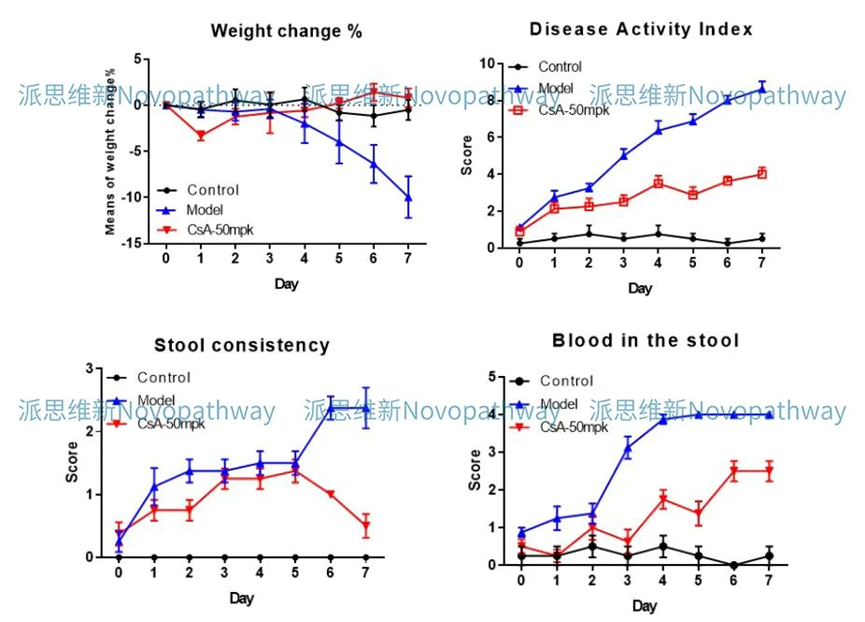
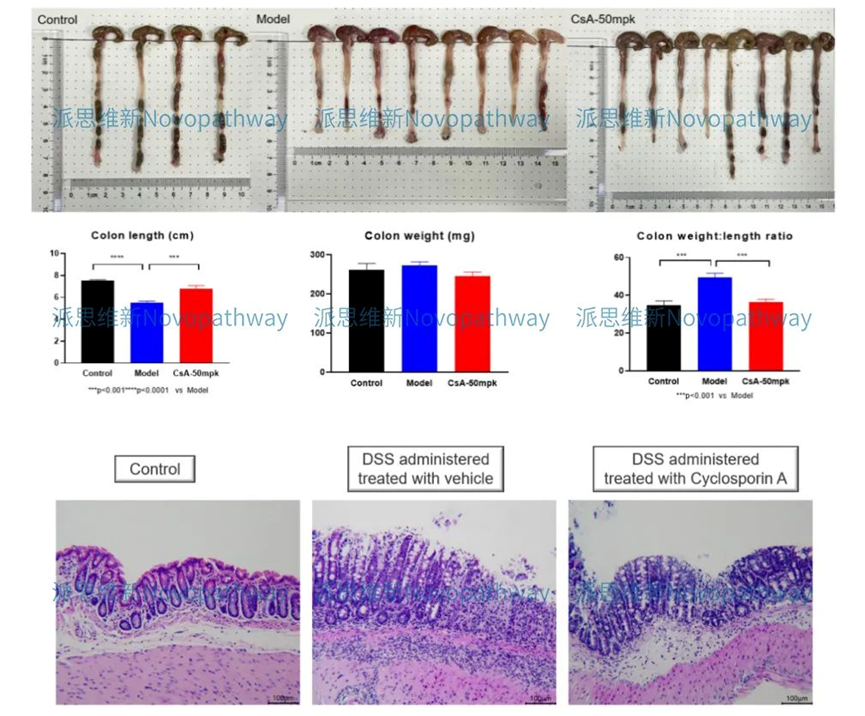
Aim:To validate the effect of CsA on DSS induced IBD model in SD rat.
Animal:SD rat, female, 6 - 8 weeks,180-200g.
Reagent:DSS , CsA

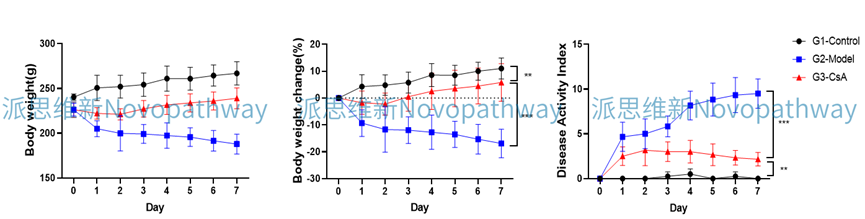

Case Study: TNBS induced IBD model
Aim:To validate the effect of SASP on TNBS induced IBD model in C57BL/6 mice.
Animal:C57BL/6 mice, female, 6 - 8 weeks,18-20g.
Reagent:TNBS , SASP

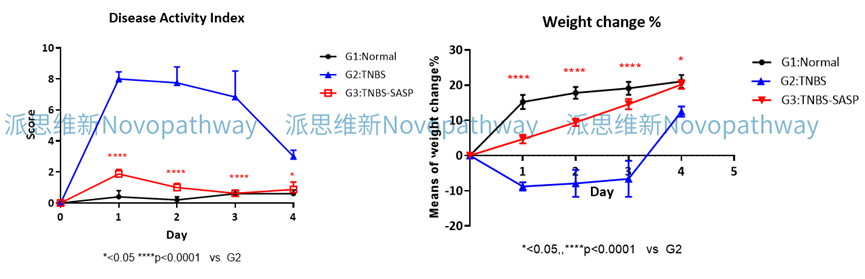
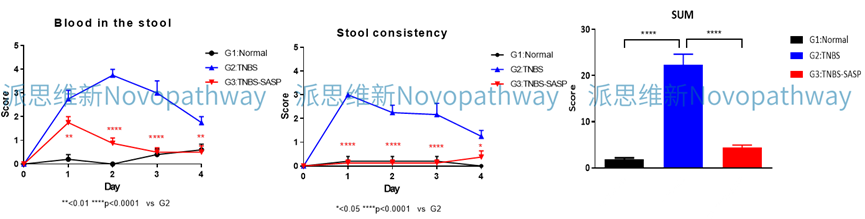
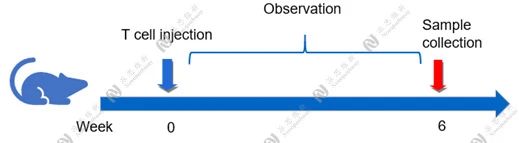
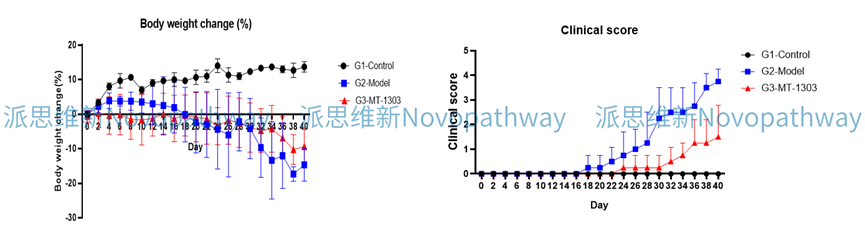
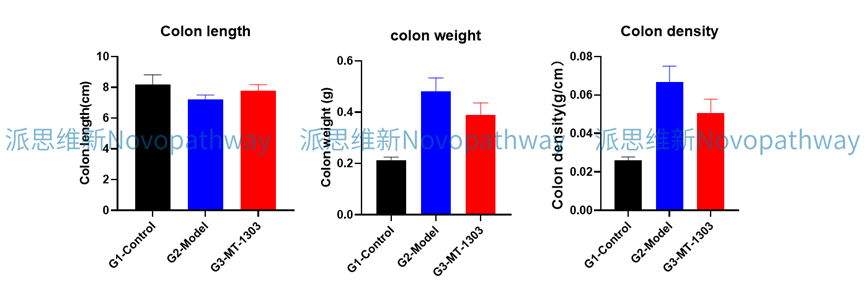
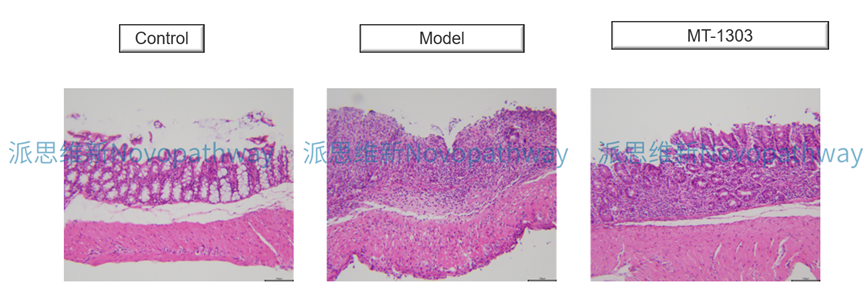
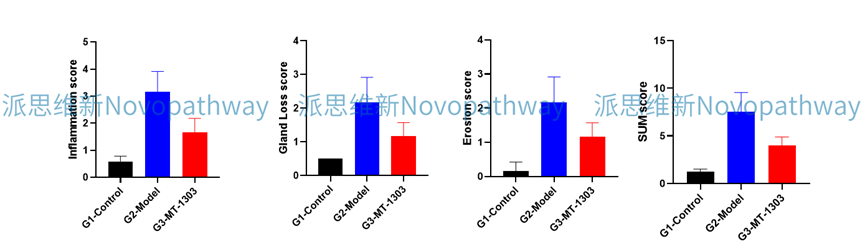
Case Study:CD4+CD45RB high T cells induced IBD model
Aim:To validate the effect of MT-1303 on CD4 + CD45RB high T cells induced IBD model in CB-17 SCID mice.
Animal:CB-17 SCID, female, 6 - 8 weeks,18-20g.
Reagent:CD4 + CD45RB high T cells , MT-1303
参考文献:
[1] Goyal N, Rana A, Ahlawat A, et al. Animal models of inflammatory bowel disease: A review [J]. Inflammopharmacology, 2014, 22(4): 219-233.
[2] Chow D K L, Leong R W L, Tsoi K K F, et al. Long-term follow-up of ulcerative colitis in the Chinese population [J]. Am J Gastroenterol, 2009, 104(3): 647-654.
[3] Ikeda M, Takeshima F, Isomoto H, et al. Simvastatin attenuates trinitrobenzene sulfonic acid-induced colitis, but not oxazalone-induced colitis [J]. Dig Dis Sci, 2008, 53(7): 1869-1875.
[4] Shinohara T, Nemoto Y, Kanai T, et al. Upregulated IL-7 receptor α expression on colitogenic memory CD4+ T cells may participate in the development and persistence of chronic colitis [J]. J Immunol, 2011, 186(4): 2623- 2632.
[5] Willis C R, Seamons A, Maxwell J, et al. Interleukin-7 receptor blockade suppresses adaptive and innate inflammatory responses in experimental colitis [J]. J Inflamm (Lond), 2012, 9(1): 39.
[6] Willis C R, Seamons A, Maxwell J, et al. Interleukin-7 receptor blockade suppresses adaptive and innate inflammatory responses in experimental colitis [J]. J Inflamm (Lond), 2012, 9(1): 39.
[7] Klein C, Nguyen D, Liu C H, et al. Gene therapy for Wiskott-Aldrich syndrome: Rescue of T-cell signaling and amelioration of colitis upon transplantation of retrovirally transduced hematopoietic stem cells in mice [J]. Blood, 2003, 101(6): 2159-2166.
[8] Tuin A, Poelstra K, de Jager-Krikken A, et al. Role of alkaline phosphatase in colitis in man and rats [J]. Gut, 2009, 58(3): 379-387.、
[9] Cruickshank S M, English N R, Felsburg P J, et al. Characterization of colonic dendritic cells in normal and colitic mice [J]. World J Gastroenterol, 2005, 11(40): 6338-6347.
[10] Chateau T, Feakins R, Marchal-Bressenot A, et al. Histological remission in ulcerative colitis: Under the microscope is the cure [J]. Am J Gastroenterol, 2020, 115 (2): 179-189 [11]
[11] Bilsborough J, Fiorino M F, Henkle B W. Select animal models of colitis and their value in predicting clinical efficacy of biological therapies in ulcerative colitis [J]. Expert Opin Drug Discov, 2021, 16(5): 567-577. [13]
[12] Lin J, Hackam D J. Worms, flies and four-legged friends: the applicability of biological models to the understanding of intestinal inflammatory diseases [J]. Dis Model Mech, 2011, 4(4): 447-456.
[13] Sumona Bhattacharya, Raymond K. Cross, An Overview of Novel and Emerging Therapies for Inflammatory Bowel Disease[J]. EMJ Gastroenterol. 2020;9(1):91-101.
[14] Grossberg LB, Papamichael K, Cheifetz AS. Review article: emerging drug therapies in inflammatory bowel disease[J]. Aliment Pharmacol Ther. 2022Apr;55(7):789-804.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




