- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
technology PLATFORM
脑卒中疾病介绍
脑卒中(cerebral stroke)又称“中风”是一种急性脑血管疾病,是由于脑部血管突然破裂或因血管阻塞导致血液不能流入大脑而引起脑组织损伤的一组疾病,包括缺血性和出血性卒中。缺血性卒中的发病率高于出血性卒中,占脑卒中总数的60%~70%。脑卒中已成为我国第一位死亡原因,也是中国成年人残疾的首要原因。
出血性脑卒中(cerebral heamorrhage)是指非外伤性脑实质内出血,包括脑出血和蛛网膜下腔出血。多种原因可引起脑血管破裂导致出血性脑卒中的发生,最常见病因是高血压合并细、小动脉硬化,其他病因包括动-静脉血管畸形、脑淀粉样血管病变、血液病、梗死后出血、脑淀粉样血管病、脑动脉炎、抗凝或溶栓治疗等。
“B”——Balance是指平衡,平衡或协调能力丧失,突然出现行走困难;
“E”——Eyes是指眼睛,突发的视力变化,视物困难;
“F”——Face是指面部,面部不对称,口角歪斜;
“A”——Arms是指手臂,手臂突然无力感或麻木感,通常出现在身体一侧;
“S”——Speech是指语言,说话含混、不能理解别人的语言;
“T”——Time是指时间,上述症状提示可能出现卒中,请勿等待症状自行消失,立即拨打120获得医疗救助。
出血性卒中
模型特点:操作简单,出血部位稳定,动物死亡率低;与人类脑出血病理过程相似,适合于脑实质出血的自然过程、病理形态学等特点的研究,可观察血液凝固过程中各种因子对脑组织代谢和血流的影响。
胶原酶模型
缺血性脑卒中
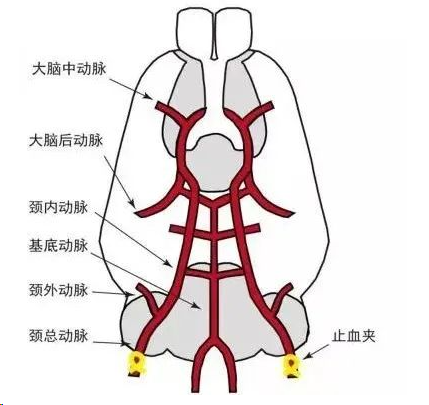
全脑缺血模型
四血管闭塞法(4-vo模型)
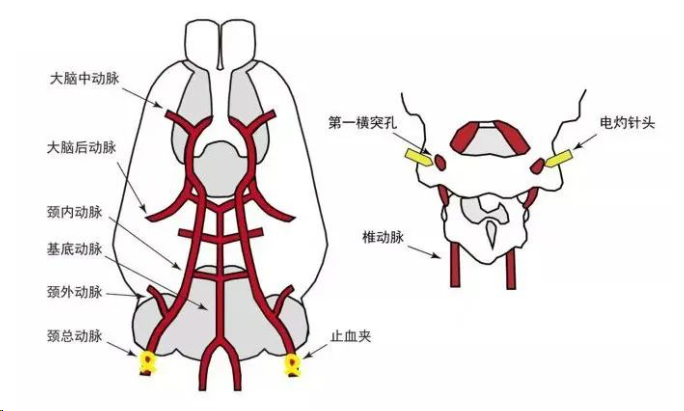
三血管闭塞模型(3-vo模型)
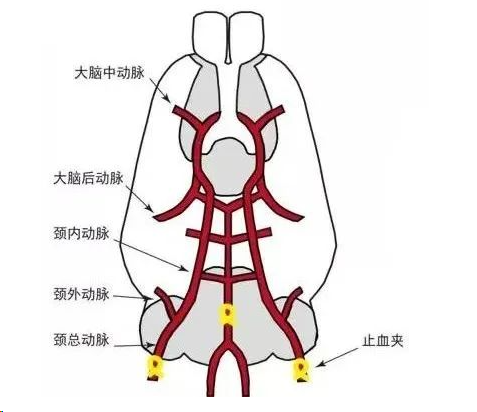
双血管闭塞/低压模型(2-vo模型)
局灶缺血模型
线栓模型
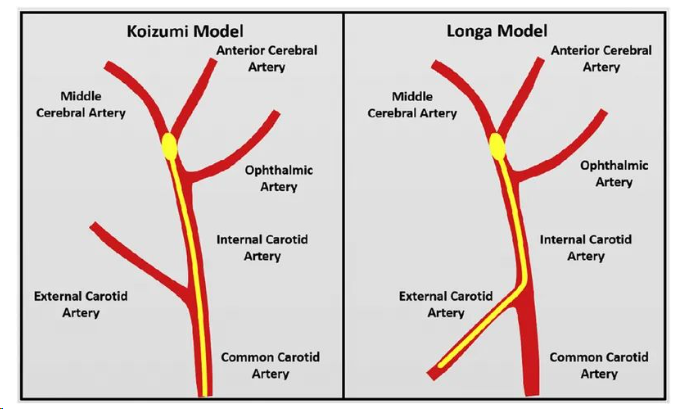
光化学法栓塞模型
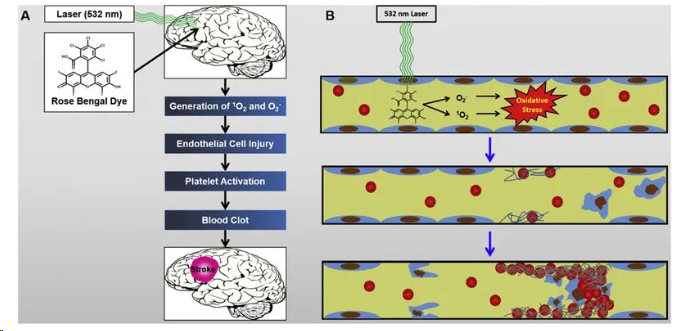
电凝法
神经功能学评分
0分,无神经损伤;
1分,提尾时对侧前肢内收屈曲(轻度神经损伤);
2分,爬行时向对侧旋转(中度神经损伤);
3分,站立或爬行时,向对侧倾倒(重度神经损伤);
4分,无自主活动伴意识障碍。

脑梗死体积(TTC染色)
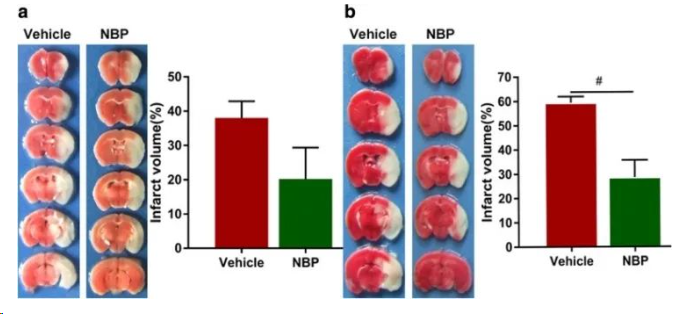
派思维新脑卒中模型案例分享
Model:Middle cerebral artery occlusion model
Animal:SD rat(male 250-280g)
Group:Control group, Model group, Positive group(Edaravone)
Endpoint:Neurological score, TTC
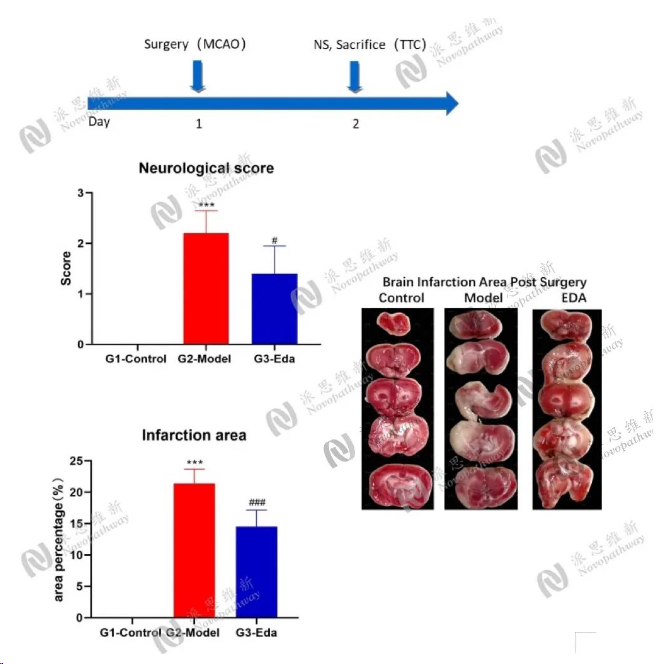
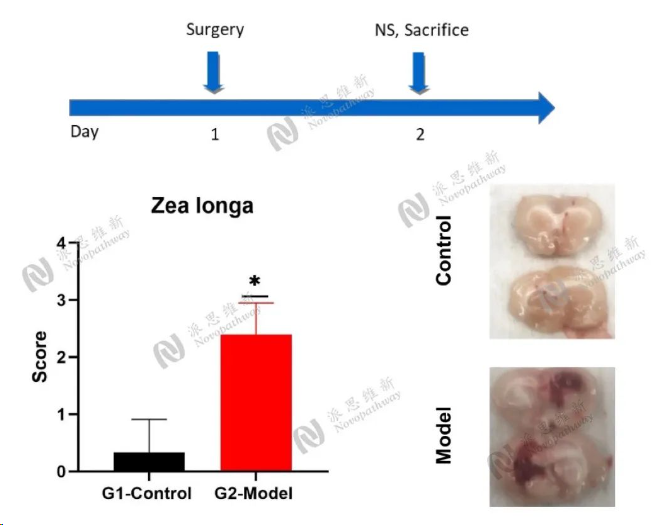
Model:Collagenase injection model
Animal:SD rat(male 250-280g)
Group:Control group, Model group
Endpoint:Neurological score, Path ology(brain)
参考文献
[1] Barthels D, Das H. Current advances in ischemic stroke research and therapies. Biochim Biophys Acta Mol Basis Dis. 2020 Apr 1;1866(4):165260. doi: 10.1016/j.bbadis.2018.09.012. Epub 2018 Sep 15. PMID: 31699365; PMCID: PMC6981280.
[2] Li F, Ma Q, Zhao H, Wang R, Tao Z, Fan Z, Zhang S, Li G, Luo Y. L-3-n-Butylphthalide reduces ischemic stroke injury and increases M2 microglial polarization. Metab Brain Dis. 2018 Dec;33(6):1995-2003. doi: 10.1007/s11011-018-0307-2. Epub 2018 Aug 16.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501





