- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
technology PLATFORM
特应性皮炎介绍
特应性皮炎(atopic dermatitis,AD)是以T细胞、嗜酸性粒细胞和肥大细胞浸润皮肤为特征的常见慢性炎性皮肤病。发达国家的流行率稳步上升,影响了10%~20%的儿童和1%~3%的成年人,超过50%的AD患者最终会发展为其他特应性疾病,如哮喘和过敏性鼻炎。AD强烈的瘙痒、皮肤炎症和其他特应性症状给个人和社会造成了巨大的负担。
特应性皮炎(AD)的发病机制与皮肤屏障功能障碍和免疫反应异常有关,该疾病的发病机制显然是多因素的,基于遗传、环境和心理因素。
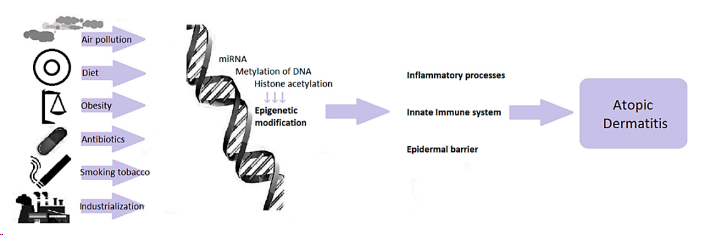
图1:依赖于环境因素的表观遗传调控
在描述特应性皮炎的发病原因时,首先就是过敏原刺激导致表皮屏障减弱。皮肤屏障受损是特应性皮炎发病机制的第一步,是发生免疫失调所必备的。先天免疫系统是人体的第一道防线,负责对可能致病的外部因素进行快速和非特异性的保护。
多种因素引起的皮肤屏障功能障碍,活化的角质形成细胞产生白细胞介素(IL)-1β、IL-6等促炎细胞因子和CCL17、CCL22等趋化因子,吸引免疫细胞进入皮损,加重AD病程进展。在AD急性期,过敏原主要诱导Th2细胞免疫反应,如分泌IL-4、IL-5、IL-13等细胞因子,导致免疫球蛋白(Ig)E类转换和免疫细胞浸润。此外,TH2相关的细胞因子调节聚丝蛋白的表达,导致皮肤屏障缺陷。当AD发展到慢性期时,Th1反应也随着干扰素(IFN)-γ的分泌而增加。皮损中的免疫细胞分泌炎症介质,激活角质形成细胞并加剧炎症反应。
AD瘙痒症状轻重不一,可为全身性、阵发性、间断性或持续性,亦可以局部症状为主。AD瘙痒形式多种多样,包括皮损所致的瘙痒,痒觉敏感和痒觉异常,夜间瘙痒伴睡眠障碍等。AD瘙痒机制复杂,涉及多种致痒介质及受体、神经通路、免疫调节、皮肤屏障功能和外界环境因素。
动物模型
目前尚未完全了解AD功能障碍和发病机制。为了更深入和便捷地研究AD,人们密切关注动物模型。已建立的AD模型大致可分为3类:自发动物模型、转基因模型、致敏剂诱导模型。
自发性动物模型
如Nc/Nga小鼠,在普通环境下会出现一系列的自身免疫疾病,从第7周龄开始,在耳朵和鼻等部位出现皮肤红斑及搔抓行为,组织病理表现为:角化过度,肥大细胞和嗜酸陛粒细胞浸润等,是目前公认最适合研究AD的动物模型之一,但费用较高,限制了其广泛运用。
如DS-Nh小鼠为另一种在普通饲养环境下可以产生自发性皮炎的近交系无毛小鼠。其皮肤症状严重程度与血清总IgE水平相关。此外,经热处理过的灭活金黄色葡萄球菌外用于DS-Nh小鼠皮肤可产生类似皮炎。因此,适合作为金黄色葡萄球菌致敏的AD模型。
转基因动物模型
包括炎症因子相关基因(IL-4、IL-18、IL-31、IL-10)转基因小鼠AD模型、皮肤屏障相关基因AD模型等。
致敏剂诱导模型
1.半抗原诱导AD模型
恶唑酮(OXZ)、2,4-二硝基氟苯(DNFB)、2,4-二硝基氯苯(DNCB)等化学物质都属半抗原,能与皮肤组织蛋白结合成为完全抗原,进而激活T淋巴细胞使之成为致敏细胞,当半抗原再次进入机体,与致敏淋巴细胞接触就会引发过敏反应。如将BALB/c小鼠背部去毛后,第1天和第2天,小鼠背部涂上100μl 0.5% DNCB和丙酮/橄榄油(3:1)的混合物。接下来的4天没有干预。从第7天开始,每2天给小鼠涂一层这种混合物,直到第28天,能成功诱导出AD模型。
对小鼠多次长期刺激,导致皮肤炎症从典型的迟发型Th1为主向慢性Th2 为主的炎症反应转变。表皮过度增生,真皮淋巴细胞、肥大细胞、嗜酸性粒细胞浸润,高表达IL-4且血清IgE升高。该模型具有低成本,可重复,可预见性、周期短的特点。
2.卵清蛋白( OVA) 诱导AD 模型
采用6-8周BALB/c雌性小鼠,Day1腹腔注射OVA溶液系统致敏,Day6皮下注射OVA溶液再次致敏。并于Day18、Day39日背部局部贴含OVA的的无菌纱布,每日更换,分2次局部致敏,各持续1周造模。AD模型小鼠皮肤肉眼可见潮红、脱屑、偶见结痂等皮炎改变;病理可见表皮细胞增厚,过度角化,真皮内淋巴细胞等浸润,小鼠血清总IgE水平显著升高。
3.尘螨诱导AD 模型
用沾满尘螨提取物的纱布贴于BABL/c 小鼠背部,诱发产生皮炎损害,表现出脱屑、糜烂、出血等症状,病理学检查可见肥大细胞、嗜酸性粒细胞、CD4+T淋巴细胞浸润,呈现趋于Th2反应,且发现有神经纤维出现在肥大细胞周围,这可能说明神经系统与AD发病存在一定的关系。因此该模型可用来研究神经系统在AD发病中的作用。
4.超抗原诱导AD模型
黄色葡萄球菌的感染是加剧AD的常见因素。从皮损处分离的金黄色葡萄球菌,65%产生外毒素具有超抗原的属性。
5.混合致敏原诱导AD模型
应用两种致敏原同时诱导小鼠产生AD样皮肤炎症,如屋尘螨变应原和SEB小鼠AD模型、DNCB与尘螨提取物小鼠AD模型等,可高效诱发小鼠出现局部皮肤炎症,伴有血清IgE水平增高,临床表现及免疫学改变类似于人类的AD,且该方法可以应用于多个小鼠品系的模型建立。同时使用半抗原和过敏原共致敏小鼠可更有效地刺激炎症,该模型常用于评价药物的干预或某些因素对AD症状的影响。
特应性皮炎的治疗
治疗AD的常用药有:糖皮质激素、钙调磷酸酶抑制剂、抗组胺药物、免疫抑制剂等。
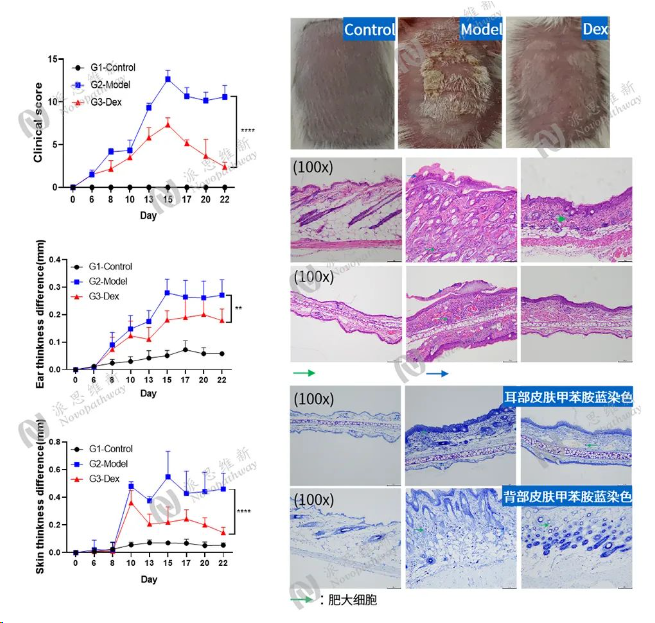
派思维新脑卒中模型案例分享
Aim:To validate the OXZ induced atopic dermatitis model in mice.
Animal:Balb/c mice, 6-8 weeks
Reagent:OXZ、olive oil
Positive drug:Dex
Timeline:Day0-1: OXZ sensitization
Day6-21: OXZ challenge once every two days
Day22: Tissue collection
参考文献
[1]: Hu X, Zhou Y, Shi J, Qi M, Li X, Yang Y, Zhu C, Wang C, Tang Z, Ma Y, Yu G.Osthole relieves skin damage and inhibits chronic itch through modulation of Akt/ZO-3 pathway in atopic dermatitis. Eur J Pharmacol. 2023 May 15;947:175649.doi: 10.1016/j.ejphar.2023.175649. Epub 2023 Mar 14. PMID: 36921706.
[2]: Alam MJ, Xie L, Yap YA, Robert R. A Mouse Model of MC903-Induced Atopic Dermatitis. Curr Protoc. 2023 Mar;3(3):e695. doi: 10.1002/cpz1.695. PMID:36913546.
[3]: Sakamoto K, Nagao K. Mouse Models for Atopic Dermatitis. Curr Protoc. 2023 Mar;3(3):e709. doi: 10.1002/cpz1.709. PMID: 36971661; PMCID: PMC10049409.
[4]: Tetsu H, Nakayama K, Nishijo T, Takuo Y, Miyazawa M. CTLA-4 suppresses hapten-induced contact hypersensitivity in atopic dermatitis model mice. Sci Rep. 2023 May 16;13(1):7936. doi: 10.1038/s41598-023-35139-y. PMID: 37193880; PMCID: PMC10188484.
[5]: Zhang J, Xu X, Wang X, Zhang L, Hu M, Le Y, Chen L, Zheng J. Topical
emollient prevents the development of atopic dermatitis and atopic march in mice. Exp Dermatol. 2023 Apr 8. doi: 10.1111/exd.14806. Epub ahead of print. PMID: 37029953.
[6]: Zhang Q, Wang H, Ran C, Lyu Y, Li F, Yao Y, Xing S, Wang L, Chen S. Anti-inflammatory effects of amarogentin on 2,4-dinitrochlorobenzene-induced atopic dermatitis-like mice and in HaCat cells. Animal Model Exp Med. 2023 Jun;6(3):255-265. doi: 10.1002/ame2.12260. Epub 2022 Sep 21. PMID: 36131559; PMCID: PMC10272903.
[7]: Wang Z, Zhang H, Qi C, Guo H, Jiao X, Yan J, Wang Y, Li Q, Zhao M, Guo X, Wan B, Li X. Ursolic acid ameliorates DNCB-induced atopic dermatitis-like symptoms in mice by regulating TLR4/NF-κB and Nrf2/HO-1 signaling pathways. Int Immunopharmacol. 2023 May;118:110079. doi: 10.1016/j.intimp.2023.110079. Epub 2023 Mar 29. PMID: 36996741.
[8]: Shao H, Deng J, Liu Y, Yang N. A Mouse Ear Model for Allergic Contact Dermatitis Evaluation. J Vis Exp. 2023 Mar 24;(193). doi: 10.3791/65120. PMID:37036234.
[9]:Bae S, Jeong NH, Choi YA, Lee B, Jang YH, Lee S, Kim SH. Lupeol alleviates atopic dermatitis-like skin inflammation in 2,4-dinitrochlorobenzene/Dermatophagoides farinae extract-induced mice. BMC Pharmacol Toxicol. 2023 Apr 25;24(1):27. doi: 10.1186/s40360-023-00668-9. PMID:37098554; PMCID: PMC10131421.
[10]: David Boothe W, Tarbox JA, Tarbox MB. Atopic Dermatitis: Pathophysiology. Adv Exp Med Biol. 2017;1027:21-37. doi: 10.1007/978-3-319-64804-0_3. PMID: 29063428.
[11]: Sroka-Tomaszewska J, Trzeciak M. Molecular Mechanisms of Atopic Dermatitis Pathogenesis. Int J Mol Sci. 2021 Apr 16;22(8):4130. doi: 10.3390/ijms22084130. PMID: 33923629; PMCID: PMC8074061.
[12]: Kim J, Kim BE, Leung DYM. Pathophysiology of atopic dermatitis: Clinical implications. Allergy Asthma Proc. 2019 Mar 1;40(2):84-92. doi:10.2500/aap.2019.40.4202. PMID: 30819278; PMCID: PMC6399565.
[13]: Avena-Woods C. Overview of atopic dermatitis. Am J Manag Care. 2017 Jun;23(8 Suppl):S115-S123. PMID: 28978208.
[14]: Torres T, Ferreira EO, Gonçalo M, Mendes-Bastos P, Selores M, Filipe P.Update on Atopic Dermatitis. Acta Med Port. 2019 Sep 2;32(9):606-613. doi:10.20344/amp.11963. Epub 2019 Sep 2. PMID: 31493365.
[15]: Ramírez-Marín HA, Silverberg JI. Differences between pediatric and adult atopic dermatitis. Pediatr Dermatol. 2022 May;39(3):345-353. doi:10.1111/pde.14971. Epub 2022 Mar 16. PMID: 35297082.
[16] 唐珏,姚志荣. 特应性皮炎瘙痒机制及相关治疗研究进展[J]. 协和医学杂志,2022,13(3):473-479. DOI:10.12290/xhyxzz.2021-0747.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501





